Stadiile inflamației și simptomele acestora.
admis
Centru educațional și metodologic integral rusesc
pentru Educație Medicală și Farmaceutică Continuă
Ministerul Sănătății al Federației Ruse
ca manual pentru studenții la medicină
8.1. Inițierea procesului inflamator
Inițierea procesului inflamator are loc ca urmare a unei leziuni tisulare, indiferent de origine:
- fizice: arsuri, frig, radiații ionizante;
- mecanice: leziuni mecanice, malocluzie a dinților, detașarea stratului epitelial al mucoasei la îndepărtarea ruloului de vată etc.;
- chimice: acizi, alcaline;
- biologice: răspunsuri imune ale HHNT și HHST cu formarea de complexe de anticorpi sau T-killers cu un antigen sau ca urmare a acțiunii agenților patogeni infecțioși, enzime care pătrund în sânge (tripsină, fosfolipază de venin de șarpe etc.).
Deși sunt numite principalele cauze ale inflamației, numărul lor este nelimitat. Acest lucru rezultă din natura însăși biologică a inflamației, care este cauzată de agenți infecțioși sau neinfecțioși. Inflamația apare ca o reacție locală, sensul ei biologic este de a limita leziunea. Eliberarea de substanțe biologic active activează reacțiile generale ale organismului care vizează restabilirea homeostaziei. Dacă nu fac față, atunci procesul local se transformă într-o boală, de exemplu, se dezvoltă bacteriemie și sepsis.
Terminologie: la denumirea organului se adaugă terminația „it” - hepatită, miocardită, gastrită, cheilită, glosită, stomatită, pulpită, parodontită.
8.2. Etapele reacțiilor locale în inflamație
- Modificare
- Tulburări vasculare, exsudație și emigrare
- Proliferare
În declanșarea (etiologia) inflamației are o importanță primordială acțiunea directă a factorului dăunător (fizic, chimic, biologic) asupra membranei lizozomului (Fig. 16). Mecanismul de apariție a proceselor inflamatorii în cavitatea bucală (pulpita, parodontită, stomatită) este similar cu inflamația altor organe. Alterarea primară sau secundară este asociată cu lizozomi.
Aceste particule intracelulare sunt „cel mai acid loc din celulă” (adică funcționează la un pH mai mic de 7). Au un set de enzime cu același mecanism de acțiune și clasă ca și enzimele tractului gastrointestinal și descompun polimerii în monomeri: proteine - la peptide și apoi la aminoacizi; acizi nucleici - la mononucleotide; carbohidrați - la monozaharide.
Enzime lizozomale - enzime de dezintegrare. În mod normal, funcția lor este de a capta proteinele citoplasmatice, membranele individuale, chiar și particulele intracelulare și de a le distruge în monomeri. Ele lucrează în interiorul particulelor, ca membrana limitează în siguranță conținutul lizozomal. Rol - actualizarea (plasticitatea) celulei. Procesul de digestie intracelulară este necesar pentru orice procese precum atrofia. Cu ajutorul acestui mecanism se realizează atrofia foliculului limfoid, a mucoasei endometriale în timpul menstruației, a țesuturilor care alcătuiesc orificiul dintelui extras etc. Acestea. lizozomii sunt necesari pentru procesul de diferențiere celulară - înlocuirea unei structuri cu alta. În timpul inflamației, funcțiile lizozomilor se modifică datorită creșterii permeabilității biomembranelor lor sub influența factorilor etiologici ai inflamației.
8.2.1. Prima etapă a inflamației - alterare
Se dezvoltă o creștere bruscă a catabolismului (alterare), acumularea de monomeri în focarul tulburării și o creștere a presiunii osmotice. Moartea mitocondriilor duce la o creștere a procesului anaerob de producere a ATP - glicoliză. Glialuronidaza și colagenaza lizozomală provoacă descompunerea acidului hialuronic, colagenului.
Evenimentul cheie este activarea factorului Hageman (XII RSK). Această proteină este proteaza cu care sunt asociate toate evenimentele ulterioare.
Rezultatul etapei 1 este alterarea + activarea factorului Hageman.
8.2.2. A doua etapă - reacții vasculare, exudație, emigrare
Patogeneza:
- factorul Hageman activează reacția de coagulare a sângelui care duce la microtromboză (nămol) și hipoxie circulatorie;
- factorul Hageman activează complementul (anafilotoxina se formează din fragmentul C3a, care distruge mastocitele - depozitul BAS);
- factorul Hageman determină activarea cascadei de formare a kininei, care determină creșterea permeabilității, excitabilității, vasodilatației și durerii.
Toate acestea duc la tromboză și edem. Ultimul simptom se explică printr-o creștere a permeabilității pereților microvaselor și o creștere a presiunii osmotice în focarul inflamației.
8.2.2.1. Reacții vasculare
Reacțiile vasculare stau la baza atât, de fapt, modificări ale fluxului sanguin în microcirculație, cât și exudație și emigrare. Un nou fenomen este încălcarea microcirculației, hiperemia, pierderea plasmei, agregarea trombocitelor, formarea coloanelor de eritrocite. Acest lucru duce la apariția microtrombozei diseminate (nămol), stază. Sângele nu poate curge liber, ceea ce duce la hipoxie. Desigur, sunt implicați factori biochimici. Agregarea necesită ADP, trombina, substanțe reglatoare.
8.2.2.2. Exudația
Exudație - eliberarea părții lichide a sângelui în focarul de inflamație, cauzată de o creștere a presiunii lui Roy în focar și o creștere a permeabilității vasculare sub influența enzimelor lizozomilor și a substanțelor biologic active (în primul rând histamină și bradikinine) . Exudatul inflamator se caracterizează prin prezența proteinelor în el și, mai ales, a fibrinogenului. Coagulând, formează un film fibrinos care delimitează focalizarea.
Reglarea celei de-a doua etape a inflamației este efectuată de „motoarele” inflamației - BAS. Factorii mastocitelor și analogii lor din sânge - bazofilele - funcționează în faza incipientă a proceselor. Acestea includ:
- Principalele proteine ale lizozomilor sunt proteinele cationice care au o serie de efecte similare ca proprietăți cu proteinele histaminei. Ele cresc permeabilitatea microvaselor, provocând exudație, emigrare. Chemotaxia este, de asemenea, un efect mediat de acestea, adică. leucocitele se deplasează în focarul inflamației de-a lungul concentrației crescânde a principalelor proteine ale lizozomilor (de la periferie la centru).
- Aminele - apar din aminoacizi. Histamina este produsă în mastocite (celule specializate ale țesutului conjunctiv situate în jurul microvaselor). În mod normal, este asociat cu heparina într-un singur complex. Unul dintre motivele eliberării histaminei este principalele proteine ale lizozomilor, al doilea este complexul antigen-anticorp. Histamina crește permeabilitatea capilarelor și venulelor prin reducerea miofibrilelor endoteliului, odată cu „încrețirea” celulelor, se formează goluri, ceea ce contribuie la exudare și edem. Histamina este principalul factor în HCT, care este eliberat devreme.
În conflictele imune, datorită acțiunii IgE fixate pe membrană, se eliberează Ca 2+ și se activează fosfolipaza A care, distrugând lipidele membranelor mastocitare, determină formarea în acestea a unor canale prin care histamina, serotonina și heparina. iesi usor.
Reacția tipică a pielii la histamina:
- hiperemie - datorită efectului asupra receptorilor de histamină ai celulelor musculare netede direct sau prin reflexul axonal.
- edem ca urmare a creșterii permeabilității capilare.
O reacție tipică la serotonină: dilatarea arteriolelor pe fondul spasmului venulelor, ceea ce duce la stagnarea locală a sângelui și eliberarea plasmei în țesuturi. LSD, care blochează receptorii M-serotoninei, suprimă umflarea.
Acetilcolina este un derivat de aminoacid, efectele active sunt mai puțin pronunțate decât cele ale histaminei.
În perioada târzie a inflamației (ore sau mai mult), noi regulatori - kinine - sunt conectați. Acestea sunt deja oligopeptide, adică. sunt formați din mai mulți aminoacizi. Bradikinina este chinina care circulă în sânge, iar kalidina se formează și acționează doar local, tk. degradat rapid de carboxipeptidază. Timp de înjumătățire - 30 sec.
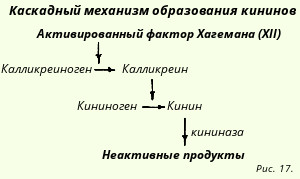
Cascada de formare a kininei este reprezentată după cum urmează (Fig. 17). Enzima kalikreina circulă în sânge, în mod normal nu este activă, se formează din ea însăși după expunerea la peptidaze (în principal factorul Hageman). Enzimele lizozomilor animalelor și bacteriilor (streptokinaza) pot activa direct cascada formării kininei, lansarea sistemului kininei este efectuată de peptidaze - enzime proteolitice. Aceasta stă la baza utilizării inhibitorilor de proteoliză (de exemplu, trasilol).
Efecte patofiziologice ale kininelor:
- Se aseamănă cu efectele histaminei (hipotensiune arterială, permeabilitate vasculară crescută), dar concentrațiile eficiente sunt de multe ori mai mici. Demararea emigrării leucocitelor.
- Provoacă direct durere.
- Bradicardie.
Terapia patogenetică
În tratamentul proceselor alergice și inflamatorii, se utilizează pipolfen și difenhidramină. Pipolfen are un agent de 10 ori mai mare pentru receptorii histaminei, dar acționează mai rău, deoarece. are un efect antihistaminic pur, iar difenhidramina blochează suplimentar acțiunea kininelor. Orice factori care fac membranele lizozomilor mai durabile inhibă formarea kininelor: salicilații, GCS.
- Alte grupe de substanțe biologic active ale fazei târzii a inflamației: hormoni, derivați ai acizilor grași (leucotriene și prostaglandine). Leucotrienele au fost mai întâi izolate din leucocite. Ele spasmează vasele de sânge și sunt, la fel ca prostaglandinele, hormoni lipidici. Format din acizi grași nesaturați, cum ar fi acidul arahidonic, în toate celulele tuturor țesuturilor.
Efectele fiziopatologice ale leucotrienelor și prostaglandinelor sunt similare cu cele ale kininelor. Ele dilată vasele de sânge, le măresc permeabilitatea, favorizează umflarea, durerea. Sindromul de durere este deosebit de pronunțat în pulpită, care se poate datora faptului că inflamația apare cu umflare, iar pulpa este situată într-o cameră neclintită - cavitatea dintelui. În astfel de gingii alterate dureros, concentrația de prostaglandine este de 20 de ori mai mare decât în mod normal. Prostaciclina (prostaglandina I 2) dilată vasele de sânge și previne agregarea plachetară, tromboxanul A 2 este antagonistul său. În mod normal, prostaglandinele și kininele sunt responsabile de hiperemia fiziologică.
Mecanismul de acțiune al salicilaților a fost controversat de mult timp, acum se știe că principalul lucru în el este blocul biosintezei prostaglandinelor. In functie de cresterea activitatii antiinflamatorii pot fi dispuse astfel: metindol - butadiona - aspirina.
8.2.2.3. Emigrare
Neutrofilele, care aderă la endoteliul vascular perturbat, secretă factori de permeabilitate (interleukina-1, leucotriene, prostaglandine) și trec (emigrează) în spațiul intercelular de-a lungul gradientului de concentrație al principalelor proteine ale lizozomilor deja formate în focarul țesutului afectat. Acolo, neutrofilele secretă factori suplimentari de chimiotaxie. Odată cu apariția lor în leziune, începe inflamația. Scopul este fagocitoza. Toate aceste evenimente aparțin fazei incipiente a inflamației. Folosind metoda „ferestrei pielii” (scarificarea pielii și un frotiu pe geamul atașat), s-a demonstrat că apariția neutrofilelor este detectată în primele 4 ore de la debutul expunerii la agentul dăunător. Faza târzie a inflamației se dezvoltă după aproximativ 24 de ore și se caracterizează prin apariția macrofagelor în focarul inflamației, după care caracterul său se schimbă, sistemul imunitar este conectat.
Mecanismul fagocitozei și distrugerii unui agent inflamator este obișnuit și constă în faptul că la locul contactului unui corp străin (bacterii, complexe imune etc.) cu membrana plasmatică a unui leucocite, macrofag, se formează invaginarea acestuia. . Pe suprafața membranei (fagozom) înșurubat astfel, începe formarea radicalului superoxid O 2 - de către mieloperoxidază, care are efect bactericid. Un defect în generarea de O 2 - duce la un fenomen numit „fagocitoză incompletă” și se manifestă prin inflamație cronică și o imagine a unei stări de imunodeficiență.
Rezultatul stadiului II: reacție vasculară sub formă de spasm, hiperemie, microtromboză și hipoxie circulatorie cu dezvoltarea triadei (deficit de ATP, acidoză, afectarea biomembranelor). Exudarea și emigrarea neutrofilelor (exsudat purulent), apoi macrofagelor (curățarea plăgii și începerea proliferării).
8.3. Proliferare - stadiul III de inflamație
Cea mai rapidă reproducere a celulelor țesutului conjunctiv - fibroblastele. De exemplu, hepatocitele, miocardiocitele și celulele mucoasei nu se pot regenera atât de repede, astfel încât cicatricile se formează la locul distrugerii lor inflamatorii. Nu există date biochimice directe care să contribuie în mod specific la lansarea proliferării în focarul unui defect tisular. Se pare că procesul se supune regula generala: cu cât sunt mai puține celule în orice volum, cu atât proliferează mai mult. Celulele lăsate singure nu au nevoie de activatori de proliferare. Ce îi face să prolifereze? Acesta este fenomenul de inhibiție a contactului. Fără el, tumorile maligne ar crește în fiecare organ.
Nota designerului de layout: textul este plasat conform sursei originale
Teoria inhibiției contactului
În membrana plasmatică a celulelor există glicoproteine și glicolipide care joacă o funcție specifică. Ele formează un fel de „antene” pe suprafața exterioară a celulelor. Atunci când celulele intră în contact, momentul primar este contactul cu „antenele”, iar cel secundar este o creștere a nivelului de cAMP din interiorul celulei, care, probabil, declanșează un lanț de reacții biochimice care conduc la suprimarea celulei. mitoză.
Se dovedește că există foarte puțin cAMP în celulele țesuturilor cu proliferare rapidă. Când există o mulțime de celule, concentrația de cAMP în ele crește brusc. Când se adaugă cAMP, creșterea celulelor încetinește: există puțin cAMP în tumorile maligne. Cu cât țesutul crește mai repede, cu atât mai puțin cAMP este în celulele sale.
Rezumatul funcțiilor lizozomilor în inflamație. Lizozomii sunt începutul și sfârșitul inflamației. Ei îl desfășoară și contribuie la rezultatul său favorabil. Alți factori inflamatori sunt motorii.
- Lizozomii efectuează alterarea țesuturilor.
- Lizozomii joacă un rol principal în creșterea concentrației de substanțe biologic active care determină a doua etapă a procesului:
- furnizează proteine de bază (cationice).
- promovează eliberarea histaminei, leucotrpenelor și, eventual, a altor factori inflamatori ca urmare a degranulării mastocitelor;
- enzimele lizozomilor activează sistemul kininei, fibrinoliza (activarea plasminei).
- Lizozomii contribuie la eliminarea procesului inflamator în sine, de exemplu, prin distrugerea complexului antigen-anticorp și a bacteriilor.
- Lizozomii sunt implicați în pregătirea pentru etapa III de inflamație prin eliminarea țesuturilor deteriorate, astfel încât inhibitorii de peptidază ajută mai bine la începutul inflamației, iar peptidazele în sine la sfârșitul acesteia.
Acești factori au stat la baza fundamentării ipotezei moderne a patogenezei inflamației: eliberarea enzimelor lizozomale, atacul acestora asupra substraturilor extracelulare (mastocite, precursori BAS). Produsele acestor reacții perturbă microcirculația în focarul inflamației. Rezultatul depinde nu numai de factorii de agresiune, ci și de abilitățile homeostatice ale organismului însuși.
8.4. Reglarea inflamației - de fapt, principiile tratamentului acesteia
- stadiu, alterare
- stabilizatori ai membranei lizozomilor (glucocorticosteroizi, salicilați, săruri de aur)
- inhibitori ai enzimelor lizozomice (kontrykal, trasilol, dexametazonă, inhibitori ai fosfolipazei)
- stadiu, tulburări vasculare, exudație, emigrare
- efecte asupra reacțiilor vasculare - blocanți ai sintezei receptorilor BAS (antihistaminice), biosinteza prostaglandinelor, leucotrienelor (salicilați)
- impact asupra proceselor de exudare - vitaminele C, PP pentru a crește biosinteza colagenului
- impact asupra procesului de emigrare – tratamentul imunodeficienței
- stadiu, proliferare: - utilizarea stimulentelor de biosinteză a proteinelor (anabolice):
- tratamentul țesutului necrotic al focarului de inflamație cu proteaze
- androgeni: contribuie la procesele de biosinteză. Importante în procesul de recuperare, acestea nu sunt suficiente. Steroizii anabolizanți sunt buni - nerabol Ei păstrează capacitatea de a crește biosinteza proteinelor, dar le lipsesc proprietățile hormonilor sexuali masculini.
8.5.Reacții generale în inflamație și diagnostic patogenetic
8.5.1 Modificări ale conținutului și raportului proteinelor plasmatice din sânge: 8.5.1.1. Albumine: în inflamația acută numărul lor crește, iar în inflamația cronică scade. Biosinteza lor este realizată numai de hepatocite. 8.5.1.2. Globuline: Un număr de proteine din această fracțiune (imunoglobuline) sunt sintetizate de celulele plasmatice. În inflamația acută, conținutul de globuline alfa-1 și alfa-2 crește, în inflamația cronică - globuline alfa-2 și gama. Acest lucru este important pentru diagnostic, deoarece imunoglobulinele aparțin fracției gamma globuline și se formează în perioada ulterioară a inflamației. Un semn al tranziției procesului într-o formă cronică - o combinație de încălcări ale conținutului de albumine și globuline se reflectă în modificări ale coeficientului albumină / globulină. 8.5.2. O creștere a conținutului de glicoproteine: fibrinogen, protrombină și componentele lor carbohidrate - acid sialic, seromucoid. Cele mai multe dintre glicoproteine sunt sintetizate în ficat, adică. creșterea lor este o reacție secundară. Cu cât inflamația este mai acută, cu atât mai multe glicoproteine în plasma sanguină. Pentru diagnostic, glicoproteinele nu dau nimic, deoarece. creșterea diabetului zaharat, în timpul sarcinii. Dar ele dau multe pentru a determina severitatea procesului.Concluzie: glicoproteinele sunt un indicator important al dinamicii inflamației și al eficacității tratamentului. Dacă în timpul tratamentului crește conținutul de glicoproteine din sânge, atunci regimul de tratament trebuie schimbat. 8.5.3. Activarea SAS și activitatea cortexului suprarenal (AAO), în special fascicular (GCS) și reticular (mineralocorticosteroizi), adică ca într-o reacție tipică la orice stres.
Efectele corticosteroizilor asupra inflamației:
- Creșterea rezistenței membranelor lizozomului.
- Creșteți rezistența peretelui vascular, prin urmare, exsudația este redusă.
- Reduceți emigrarea leucocitelor către focarul inflamației.
- Inhiba fagocitoza.
- Inhibă dezvoltarea țesutului conjunctiv, inhibă creșterea și reproducerea fibroblastelor
- Reduceți biosinteza anticorpilor, precum și a tuturor proteinelor.
- Suprimă formarea limfocitelor T, provocând atrofia organelor limfoide
Prin urmare, corticosteroizii sunt folosiți pe scară largă în tratamentul inflamației, dar prin suprimarea locală a procesului, ei contribuie la generalizarea acestuia. 8.5.4. Febră. Leucocitoza neutrofilă determină producerea de novo a unei proteine specifice, interleukina-1, numită anterior pirogen leucocitar. Determină o schimbare a punctului de referință al centrului de termoreglare la un nivel superior, stimulează fagocitoza și activitatea T-killers. 8.5.5. leucocitoza. Sub influența factorilor leucocitari și a produselor de degradare a țesuturilor focarului de inflamație, se formează un factor de stimulare care activează proliferarea celulelor germenului mieloid al măduvei osoase, atât granulare, cât și monocitare.
8.6. Trecerea inflamației acute la cronice
Baza este apariția proceselor autoalergice, atât la modificarea în cursul inflamației propriilor proteine, cât și ca urmare a asemănării cu agenții patogeni bacterieni. Există o formare a unui ciclu stabil de legături de patogeneză în funcție de tipul unui cerc vicios.
Terapia patogenetică: este foarte importantă includerea terapiei antialergice în regimul de tratament antiinflamator: tratamentul unei posibile stări de imunodeficiență.
8.7. inflamație și homeostazie
Desigur, inflamația joacă practic un rol protector. Cu ajutorul acestui proces complex, organismul caută să delimiteze, să înconjoare factorul de agresiune sau propriul țesut mort și să le îndepărteze pentru a menține constanța funcțională și morfologică a organismului.
Atât mecanismele de prevenire locală a tulburărilor homeostaziei, cât și reacțiile sistemice generale de restabilire a homeostaziei sunt vizate în acest sens. Cu acțiunea excesivă a factorului de agresiune, mecanismele homeostatice nu pot face față și, în acest caz, inflamația se transformă într-o boală.
În dezvoltarea procesului inflamator, se obișnuiește să se facă distincția între anumite etape. În acest articol, vom analiza în detaliu toate etapele bolii și manifestările acesteia.
Stadiile inflamației și simptomele acestora
În cursul bolii, se disting următoarele etape:
modificare
exudatie
proliferare
Etapele fiecărei etape ale bolilor inflamatorii
Acestea sunt cele trei etape principale ale inflamației, deși oamenii de știință din timpul nostru au ajuns la concluzia că nu există limite clare, deoarece alterarea poate fi exprimată în perioada exsudației purulente. Prin urmare, pentru fiecare etapă a bolii, se disting următoarele etape:
Modificare
- stadiul primar;
- etapa secundara;
Exudația și emigrația
Proliferare și reparare:
- proliferare
- sfârşitul inflamaţiei
Detalii despre simptomele fiecărei etape de inflamație
Luați în considerare fiecare dintre etapele inflamației:
Alterarea ca etapă în dezvoltarea inflamației
Atunci când sunt deteriorate în celulele tisulare în stadiul primar al modificării, apar modificări în structura sa, precum și reacții chimice în ele care apar pentru a menține viața. Încălcările afectează celulele în moduri diferite, unele mor, altele sunt mai stabile și continuă să trăiască, iar altele devin active.
Alterarea secundară este independentă de agentul inflamat; în absența acestuia, continuă și ea. Agentul flogogen își manifestă în primul rând influența în membranele celulare, ceea ce are consecințe. Alterarea secundară poate fi descrisă ca „auto-vătămare”, deoarece după deteriorarea lizozomilor, enzima eliberată în exterior exacerba daunele cauzate de factorii adversi. Unele celule în această etapă nu mor, ci mai degrabă încep să producă substanțe active care afectează alte celule și zone.
Stadiul exsudației bolilor inflamatorii și simptomele acesteia
Exudația este procesul de eliberare a proteinelor, a celulelor, a părții lichide a sângelui în materia tisulară.
Principalul motiv pentru astfel de fenomene în acest stadiu al inflamației este permeabilitatea crescută a pereților vaselor de sânge. Cu vasodilatație, decalajele dintre celulele endoteliale cresc și ele. Când proteina este eliberată, cantitatea de lichid crește, în timp ce se observă o creștere a presiunii oncotice. Ca rezultat, proteinele sunt descompuse în molecule mai mici. Iar hiperonkia și hiperosmia contribuie la creșterea lichidului în zonele inflamate.
Stadiul emigrării inflamatorii și simptomele acesteia
Emigrarea este procesul de părăsire a leucocitelor prin peretele vaselor de sânge. Acesta este un proces natural, dar cu inflamația este mai extins. Producția de leucocite în acest stadiu al inflamației afectează permeabilitatea membranei bazale.
Finalizarea inflamației în stadiul de proliferare
Aceste etape ale bolii se caracterizează printr-o schimbare treptată de la procese distructive la procese de restaurare. Celulele se înmulțesc, înlocuind morții. Are loc recuperarea, organismul elimină toxinele acumulate în timpul inflamației, iar enzimele sunt inhibate.
Cu leziuni minore însoțite de inflamație, celulele se recuperează de obicei complet. Cu daune mai semnificative, o cicatrice rămâne la locul inflamației, deoarece odată cu pierderea unui număr mare de celule, țesutul conjunctiv înlocuiește defectul.
1. Definiție, teoria modernă a inflamației și a sistemului macrofagic
2. Fazele inflamației: alterarea, exsudația și proliferarea, relația și interdependența lor
3. Nomenclatura inflamaţiilor. Clasificare
1. Doctrina modernă a inflamației și a sistemului macrofage
Inflamația este o reacție complexă protector-adaptativă vascular-mezinchimală a organismului la afectarea tisulară de către diverși factori patogeni; această reacție are ca scop distrugerea agentului care a cauzat deteriorarea și repararea țesutului deteriorat.
Reacția inflamatorie se dezvoltă în teritoriu histion- țesuturi și celule din zona microvasculaturii, care combină următoarele tipuri de vase de sânge: arteriole, precapilare (arteriole precapilare), capilare, postcapilare (venule postcapilare), venule.
2. Fazele inflamației
Inflamația constă din 3 faze care se dezvoltă succesiv: alterare, exudare și proliferare.
Faza de început a inflamației modificare- se manifesta prin distrofie si necroza tesuturilor si celulelor de pe teritoriul histiei. În acest caz, are loc o eliberare de mediatori inflamatori de origine plasmatică și celulară (histamină, serotonină, leucokine, limfokine, monokine etc.). Mediatorii inflamatori sunt eliberați în mod deosebit activ: trombocite, bazofile, labrocite, neutrofile, limfocite și monocite (macrofage).
Mediatorii inflamatori stimulează dezvoltarea fazei a doua – exsudații, care se desfășoară în 6 etape:
- hiperemie inflamatorie a vaselor de sânge ale microvasculaturii;
– permeabilitate crescută a peretelui vascular;
- exudarea (ieșirea din lumenul vasului) a componentelor plasmei sanguine;
- emigrarea celulelor sanguine;
- fagocitoză;
- formarea de exudat și infiltrat celular inflamator.
Faza finală a inflamației proliferare(reproducție) - asigură refacerea țesutului deteriorat sau formarea cicatricilor.
Astfel, în fazele a 2-a și a 3-a de inflamație se formează un infiltrat celular și proliferează din celule de origine hematogenă și histiogenă (țesut local).
La celulele hematogeneîn focarul inflamației se află trombocitele, eritrocitele, neutrofilele, eozinofilele, bazofilele, limfocitele T și B, celulele plasmatice (derivate ale limfocitelor B) și macrofagele (MPF) - derivați ai monocitelor din sânge.
Celulele SMF (sistemul de macrofage) includ: monocite din sânge, histiocite de țesut conjunctiv, celule stelate Kupffer din ficat, macrofage alveolare ale plămânilor, macrofage libere și fixe ale ganglionilor limfatici, splina și măduva osoasă roșie, macrofage pleurale și peritoneale. ale cavităților seroase, macrofage ale membranelor sinoviale ale articulațiilor, osteoclaste ale țesutului osos, celule microgliale ale sistemului nervos, celule epitelioide și gigant ale granuloamelor infecțioase și invazive și granuloamelor cu corp străin.
Funcția principală a microfagelor (neutrofile și eozinofile) și a macrofagelor (MPF) este fagocitoza agenților patogeni de origine exogenă și endogenă. În plus, celulele de origine hematogenă (trombocite, bazofile, neutrofile, limfocite, monocite) secretă mediatori inflamatori care excită și susțin răspunsul inflamator, imunoglobuline (plasmocite), îndeplinesc funcții de reglare și ucigaș (limfocitele T).
Pentru grup celule histiogene include celulele epiteliale cambiale ale membranelor mucoase, pielea, glandele, organele parenchimatoase, labrocite (bazofile tisulare, mastocite) și celule ale RES propriu-zis - celule adventițiale și endoteliale ale vaselor de sânge ale microvasculaturii, fibroblaste, fibrocite și celule reticulare.
În focarul inflamației, datorită reproducerii celulelor epiteliale cambiale, parenchimul unui organ sau țesut este restaurat, labrocitele secretă, ca și celulele hematogene, mediatori inflamatori, celulele adventive se diferențiază în fibroblaste și fibrocite, sintetizând substanța principală, elastică și fibrele de colagen ale țesutului conjunctiv, celulele endoteliale sunt implicate în regenerarea vaselor de sânge ale microvasculaturii, celulele reticulare sintetizează fibre reticulare (argirofile) și refac stroma reticulară a organelor sistemului imunitar.
Astfel, parenchimul deteriorat al organelor și țesuturilor din focarul inflamator este restabilit datorită celulelor epiteliale cambiale, în timp ce funcția RES este de a restabili țesutul conjunctiv și stroma reticulară a organelor și țesuturilor, regenerarea vaselor de sânge ale microvasculaturii.
Se știe că inflamația este un complex de procese care sunt atribuite unor astfel de modificări de bază ale țesutului și vasculare, cum ar fi alterarea, adică deteriorarea țesuturilor, exudația, care combină un complex de modificări vasculare și tisulare, exprimate prin încălcarea permeabilității peretelui vascular cu eliberarea elementelor sanguine și exudatul în afara peretelui și proliferarea - reproducerea elementelor tisulare locale.
Mecanismul de declanșare pentru declanșarea procesului inflamator este alterarea sau deteriorarea țesuturilor. Deteriorarea este urmată de fenomenele de exudare și proliferare.
Raportul dintre procesele de exudare, alterare și proliferare poate fi diferit. În funcție de aceste rapoarte, se poate construi o clasificare a proceselor inflamatorii.
Alterarea, adică afectarea țesuturilor, poate fi exprimată în grade diferite - de la abia vizibilă până la distrugerea gravă și degradarea țesuturilor. Procesele de alterare asociate cu afectarea țesuturilor afectează toate organele și țesuturile corpului. Uneori, schimbările pot fi semnificative. În alte cazuri, acestea pot fi limitate la procese mici care pot fi identificate doar la microscop.
Din punct de vedere morfologic, alterarea este o distrofie de tot felul și necroză. Alterarea poate fi sub formă de proteine, grăsimi, picături hialine și alte degenerări ale parenchimului de organe. În stroma organelor, procesele pot apărea sub formă de mucoid, umflături fibrinoide, dezintegrare celulară aglomerată și detectarea proteinei argirofile colastromină. De asemenea, puteți găsi zone de modificări fibrinoide, până la necroză fibrinoidă. După cum se poate observa, o serie de procese, atât în celulele parenchimului, cât și în celulele țesutului conjunctiv din sistemul vascular, au loc în timpul alterării.
Modificările alternative ale sistemului nervos central includ liza substanței tigroide a celulelor, picnoza, dezintegrarea nucleelor și a citoplasmei.
La nivelul mucoaselor, fenomenele de alterare includ procese precum descuamarea, sau respingerea celulelor epiteliale de la baza lor. Uneori, acest proces capătă dimensiuni semnificative, expunând membrana cochiliei. Glandele mucoase sub influența unui iritant încep să secrete intens mucus. Lumenul glandelor și canalele excretoare sunt umplute cu mucus și se extind, epiteliul descuamat este amestecat cu mucusul. Deosebit de intensă este inflamația mucoaselor tractului gastro-intestinal și a organelor respiratorii. Membranele mucoase în timpul inflamației sunt acoperite cu o cantitate mare de mucus, uneori cu un amestec de puroi.
Alterarea determină factorul de afectare a țesuturilor sub formă de necroză, distrofie, descuamare etc. Dacă aceste procese apar fără fenomene de hiperemie, exsudație și proliferare, atunci ele nu aparțin inflamației. În absența uneia dintre componentele procesului inflamator, nu o putem atribui inflamației.
În inflamația însăși, în timpul degradarii elementelor celulare, din ele sunt eliberate o serie de substanțe chimice, care modifică reacția mediului, afectează peretele vaselor de sânge și dezvoltarea proceselor proliferative. Când celulele se descompun, histamina și serotonina sunt eliberate. Aceștia sunt produșii de descompunere ai acizilor nucleici. Ele măresc reacția țesutului vascular în focarul inflamației, favorizează emigrarea leucocitelor și stimulează proliferarea. Produsele de degradare determină cursul ulterioar de dezvoltare și gradul proceselor inflamatorii.
În spatele modificărilor alternative se află fenomene din sistemul vascular sub formă de exudație și emigrare. În viitor se dezvoltă procesele de proliferare.
Exudația în sensul cel mai larg al acestui proces este o reacție vasculară care apare atunci când țesuturile sunt deteriorate. Încălcarea este însoțită de o creștere a permeabilității țesutului vascular și de ieșirea din lumenul vaselor în spațiul perivascular al exudatului și al celulelor sanguine. Leucocitele neutrofile, eritrocitele și alte celule migrează. Încălcarea fluxului de sânge și circulație limfatică este unul dintre cele mai izbitoare semne morfologice ale inflamației.
Modificarea vaselor începe cu o contracție reflexă a lumenului arterelor și arteriolelor mici, capilare, care este ulterior înlocuită de extinderea întregii zone vasculare în focarul inflamației. Apare hiperemia inflamatorie, care determină o serie de manifestări clinice ale inflamației, cum ar fi febră, roșeață a zonei inflamate.
Odată cu inflamarea vaselor limfatice, fluxul limfatic se accelerează mai întâi, apoi se încetinește. Vasele limfatice debordează cu limfă și leucocite. Uneori, tromboza limfatică apare în vasele limfatice. Acest proces este combinat cu procesele de tulburări circulatorii sub forma unei încetiniri a mișcării fluxului sanguin, extinderea pereților vaselor de sânge și dezvoltarea hiperemiei inflamatorii. Gradul de hiperemie inflamatorie depinde de structura organului, de gradul de încălcare a acestor procese, precum și de starea organelor circulatorii. În organe precum corneea și valvele cardiace, unde capilarele sunt în mod normal absente, fenomenele de alterare predomină în timpul dezvoltării inflamației, apoi, pe măsură ce procesul se dezvoltă, țesutul se dezintegrează în aceste organe și vasele cresc din zonele învecinate, care sunt incluse în inflamația. reacţie.
Când se examinează țesutul dintr-o zonă inflamată la microscop electronic, se observă migrarea leucocitelor, care are loc între celulele endoteliale ale capilarelor. Majoritatea leucocitelor care migrează prin pereții vasului sunt leucocite neutrofile, în special limfocite segmentate, monocite, mai rar eozinofile. Cu afectarea semnificativă a celulelor endoteliale, eritrocitele și trombocitele migrează. Celulele migratoare iau parte la fagocitoză.
În cazul inflamației, cu fenomenul de exudare are loc o efuziune de exudat, care constă din părți lichide și elemente celulare. Natura exudatului în fiecare caz este eterogenă. În unele cazuri predomină componenta lichidă a plasmei, în altele se unește procesul de emigrare a elementelor celulare.
Exudatele diferă nu numai prin conținutul de proteine, ci și prin compoziția celulară. În unele cazuri predomină celulele neutrofile, în altele - mononucleare (monocite) și altele; în plus, celulele care sunt respinse din membranele mucoase și din alte tegumente se unesc.
Proliferarea este considerată cu fenomenele de alterare și exudare. Principalele elemente celulare implicate în procesele de proliferare sunt celulele locale RES. Acestea includ celule reticulare, histiocite, epitelioide, limfoide, plasmatice, fibroblaste catarg, fibrocite și toate celulele mezenchimale legate de sistemul de țesut conjunctiv. Aceste celule se înmulțesc, cresc cantitativ și alcătuiesc cea mai mare parte a elementelor celulare în timpul inflamației.
Inflamația este o reacție protectoare și adaptativă a organismului formată în procesul de evoluție, care urmărește localizarea, distrugerea sau îndepărtarea unui agent patogen din organism și caracterizată prin fenomene de alterare, exudare și proliferare.
Există trei puncte de remarcat în această definiție. În primul rând, inflamația ca reacție s-a format în procesul de evoluție. În al doilea rând, inflamația îndeplinește un rol protector și adaptativ și are ca scop localizarea, distrugerea sau îndepărtarea unui factor dăunător din organism. În al treilea rând, inflamația se caracterizează prin coexistența a trei manifestări: alterări (leziuni tisulare), exudație (acumularea de lichid în țesuturi) și proliferare (proliferarea elementelor celulare și tisulare).
Etiologia inflamației
Cauza inflamației pot fi factori dăunători foarte diverși: mecanici, fizici (arsuri, radiații ionizante), chimici (acțiunea acizilor, alcaline, otrăvuri), biologici (microbi, viruși, ciuperci patogene, helminți, protozoare). În plus față de diferiți iritanți exogeni, factorii endogeni participă și la inflamație: de exemplu, țesutul necrotic, fluxul de sânge, hematom, atac de cord, cheaguri de sânge, depunere de sare.
Procesul patologic, în funcție de locul de acțiune al factorului dăunător, se caracterizează printr-o manifestare diferită.
Clasificarea formelor de reacție inflamatorie
În funcție de componenta care predomină în răspunsul inflamator, inflamația este împărțită în: alternativă (principala manifestare este afectarea țesuturilor), exudativă (există o efuziune pronunțată în focarul inflamator) și proliferativă (procesele de reproducere celulară ies în prim-plan).
Inflamația exudativă, la rândul său, este împărțită în următoarele tipuri:
inflamație seroasă - cu exudat lichid care conține proteine și nu conține FEK.
inflamație fibrinoasă, când exudatul conține o cantitate semnificativă de fibrină, care precipită pe țesuturile inflamate sub formă de fire și filme. Tipurile de inflamație fibrinoasă sunt inflamație diftiritică- la îndepărtarea peliculelor de fibrină se detectează un ulcer hemoragic și inflamație lobară- filmele sunt usor separate.
inflamație purulentă, în care exudatul conține un număr mare de leucocite, majoritatea moarte.
inflamație hemoragică - inflamație cu exudat care conține globule roșii (sânge în exudat).
inflamație ichoră, când microflora putrefactivă se instalează în exsudat.
Inflamația este împărțită în acută, subacută și cronică.
Semne cardinale de inflamație.
Aceste semne au fost descrise de Galen și Celsus, dar nu și-au pierdut semnificația până în prezent, deoarece prezența combinației lor face posibilă diagnosticarea inflamației și, în plus, anumite mecanisme patofiziologice stau în spatele fiecărui semn.
Semnele inflamației includ:
roșeață (rubor). Roșeața zonei inflamate este asociată cu dezvoltarea hiperemiei arteriale, în care arterele se extind și numărul lor crește, iar fluxul de sânge stacojiu bogat în oxigen crește. Cu toate acestea, trebuie remarcat faptul că, odată cu dezvoltarea hiperemiei venoase puternice, roșeața se poate transforma în cianoză.
umflare (tumoare). O creștere a volumului zonei inflamate este asociată cu dezvoltarea edemului.
căldură (calor). O creștere a temperaturii zonei inflamate se datorează mai multor factori. În primul rând, este asociată cu hiperemia arterială, adică cu afluxul de sânge mai cald. În al doilea rând, printre polipeptidele biologic active formate în focarul inflamației, se numără cele care sunt factori pirogeni (care provoacă febră). În al treilea rând, intensificarea proceselor metabolice, intensificarea unui număr de reacții exoterme duce și la o creștere locală a temperaturii.
durere (dolor). Durerea zonei inflamate este cauzată de iritarea receptorilor de durere ai substanțelor biologic active, precum și ca urmare a comprimării acestora prin edem inflamator.
disfuncție (functio laesa). Dacă în orice organ există o sursă de iritație dureroasă, atunci corpul cruță acest organ și funcția sa va fi redusă. În plus, edemul inflamator, care comprimă organul, și alterarea țesutului duce la o scădere a funcției.
Semne comune de inflamație
Inflamația este un proces care se manifestă nu numai prin semne locale pronunțate, ci și prin modificări foarte caracteristice și adesea semnificative în întregul corp.
Ce semne generale pot indica dezvoltarea inflamației?
Modificări ale numărului de leucocite în periferiecare sânge: leucocitoză (se dezvoltă cu marea majoritate a proceselor inflamatorii) sau mult mai rar leucopenie (de exemplu, cu inflamație de origine virală). Leucocitoza se datorează activării leucopoiezei și redistribuirii leucocitelor în fluxul sanguin. Principalele motive pentru dezvoltarea sa includ stimularea sistemului simpatoadrenal, expunerea la anumite toxine bacteriene, produse de degradare a țesuturilor și o serie de mediatori inflamatori (de exemplu, interleukina-I, factorul de inducție a monocitopoiezei etc.).
Febră se dezvoltă sub influența factorilor pirogene proveniți din focarul inflamației, precum lipopolizaharidele, proteinele cationice, interleukina-I.
Modificarea „profilului” proteic al sângelui Se exprimă prin faptul că în timpul unui proces acut, așa-numitele „proteine de fază acută” (APF) ale inflamației sintetizate de ficat - proteina C reactivă, ceruloplasmină, haptoglobină, componente ale complementului etc., se acumulează în sânge. .si mai ales gamma globuline.
Modificări ale compoziției enzimatice a sângelui sunt exprimate printr-o creștere a activității transaminazelor (de exemplu, alanin transaminaza în hepatită; aspartat transaminaza în miocardită), hialuronidază, trombokinaza etc.
Creșterea vitezei de sedimentare a eritrocitelor (ESR) datorită scăderii sarcinii negative a eritrocitelor, creșterii vâscozității sângelui, aglomerării eritrocitelor, modificărilor spectrului proteic al sângelui și creșterii temperaturii.
Modificări hormonaleîn sânge sunt, de regulă, o creștere a concentrației de catecolamine, corticosteroizi.
Modificări ale sistemului imunitar și reacții alergiceganisma exprimată printr-o creștere a titrului de anticorpi, apariția limfocitelor sensibilizate în sânge, dezvoltarea reacțiilor alergice locale și generale.
În plus, focarul inflamației poate fi sursăreflexe patologice(de exemplu, dezvoltarea anginei cu colecistită, aritmii cardiace cu apendicită), intoxicaţie organism şi septicemie.
Mecanisme de dezvoltare a inflamației. Componentele inflamației
Dinamica procesului inflamator, indiferent de cauzele care îl provoacă, este întotdeauna destul de standard, adică. inflamația este în esență un proces „miopatogenetic”.
Baza patogenetică a inflamației constă din trei componente interdependente - alterare, exudare si proliferare .
Modificare
Modificare(din lat. alteratio - schimbare). Alterarea în focarul inflamației este înțeleasă ca un complex de modificări metabolice, fizico-chimice, structurale și funcționale, precum și formarea și/sau activarea mediatorilor inflamatori. Se obișnuiește să se facă distincția între alterarea primară și secundară în focarul inflamației.
Alterarea primară are loc ca răspuns la impactul direct al factorului flogogen. Reacțiile de alterare primară, parcă, prelungesc acțiunea cauzei inflamației.
Alterarea secundară are loc atât sub influența unui stimul flogogen, cât și a factorilor de alterare primari. Aceste efecte sunt mediate de sistemul nervos, de factori fizico-chimici (acidoza etc.) si in principal de mediatorii inflamatori.
schimbari de schimb odată cu dezvoltarea alterării secundare, acestea includ intensificarea proceselor de descompunere a carbohidraților, grăsimilor și proteinelor, creșterea glicolizei anaerobe și a respirației tisulare, decuplarea oxidării și fosforilării biologice și scăderea activității proceselor anabolice. Consecința acestor modificări este o creștere a producției de căldură, dezvoltarea deficienței de macroergi, acumularea de produse metabolice și formarea de mediatori inflamatori.
Complex de modificări fizice și chimice include acidoza, hiperionia (acumularea de ioni de K +, Cl -, HPO, Na + în focarul inflamației), disionia. hiperosmie, hiperonie (datorită creșterii concentrației proteinelor, dispersiei și hidrofilității acesteia).
Modificări structurale și funcționaleîn timpul inflamației sunt foarte diverse și se pot dezvolta la nivel subcelular, celular și organ.
Natura regulată a dezvoltării inflamației se datorează în mare parte mediatorilor săi.
Mediatorii inflamatori sunt un complex de substanțe fiziologic active care mediază acțiunea factorilor flogogeni care determină dezvoltarea și rezultatul procesului inflamator.
De origine distinge condiționat între mediatorii celulari și plasmatici (umorali).
Exudația
Exudația- (din lat. exsudatio - transpiratie). Această componentă include o triadă: a) reacții vasculare și modificări ale circulației sângelui în focarul inflamației; b) ieșirea părții lichide a sângelui din vase - exudația propriu-zisă; c) emigrare (din latină emigratio - evacuare) - eliberarea leucocitelor în focarul de inflamație și dezvoltarea unei reacții fagocitare.
Dinamica reacțiilor vasculare și a modificărilor circulației sanguine în timpul dezvoltării inflamației este stereotipată: la început, apare un spasm reflex pe termen scurt al arteriolelor și precapilarelor odată cu încetinirea fluxului sanguin. Apoi, înlocuindu-se reciproc, se dezvoltă hiperemia arterială (datorită dominanței efectelor colinergice asupra peretelui vaselor, acidozei, hiperkaliioniei, distrugerii cuplurilor de țesut conjunctiv din jurul vaselor și, cel mai important, acumulării de mediatori inflamatori); hiperemie venoasă (datorită microtrombozei venelor și a vaselor limfatice, umflarea endoteliului, poziționarea marginală a leucocitelor, nămolurile de sânge, comprimarea vaselor prin exudat); prestasis (fluxul de sânge sacadat, mișcarea pendulului a sângelui) și, în final, staza - oprirea fluxului sanguin. Ca urmare a stazei, se formează un fel de barieră care asigură o funcție restrictivă a focarului inflamației.
Ieșirea părții lichide a sângelui în focarul de inflamație (exsudația reală) are loc din cauza unei creșteri accentuate a procesului de filtrare, difuzie, osmoză și transport microvezicular, iar acumularea de lichid în exces în țesuturi este asociată cu o scaderea procesului de resorbtie datorita cresterii presiunii venoase. Exudatul ca fluid inflamator, spre deosebire de transudat, conține o cantitate mare de proteine (cel puțin 3-5%), enzime, imunoglobuline, celule sanguine și resturi de elemente tisulare. Datorită exsudației, focarul inflamației este delimitat, toxinele și produsele de degradare a țesuturilor sunt diluate, iar protecția împotriva factorilor flogogeni și a celulelor deteriorate se realizează cu ajutorul enzimelor și imunoglobulinelor.
Emigrarea leucocitelor către focarul inflamației începe cu poziția lor marginală (parietală), care poate dura câteva zeci de minute. Apoi granulocitele (prin goluri interendoteliale) și agranulocitele (prin citoemză - transfer transendotelial) trec prin peretele vascular și se deplasează spre obiectul fagocitozei. Mișcarea amiboidă a leucocitelor este posibilă datorită modificărilor reversibile ale stării citoplasmei lor (tranziția reciprocă a gelului la sol-tixotropie) și a tensiunii superficiale a membranelor, a „polimerizării” reversibile a actinei și miozinei folosind energia glicolizei anaerobe ATP. Mișcarea direcționată a leucocitelor se explică prin acumularea de chemoatractanți în focarul inflamației - proteine, polipeptide, deșeuri ale microbilor (chemotaxie), creșterea temperaturii (termotaxie), precum și dezvoltarea condițiilor pentru galvanotaxie, hidrotaxie, thigmotaxis (din greacă thigma - atingere).
Fagocitoza este o reacție de protecție și adaptare a organismului dezvoltată evolutiv, care constă în recunoașterea, captarea activă (absorbția) și digestia microorganismelor, a celulelor distruse și a particulelor străine de către celule specializate - fagocite. Acestea includ PMN (în principal neutrofile), celule ale sistemului de celule mononucleare fagocitare (monocite, macrofage tisulare), precum și celule Kupffer din ficat, celule mezangiale renale, celule gliale din SNC etc.
Există 4 etape ale fagocitozei: 1) apropierea fagocitei de obiect; 2) aderenta (atractie, aderenta); 3) capturarea obiectului fagocitat; 4) poziția intracelulară și digestia obiectului, precum și îndepărtarea resturilor obiectului în spațiul extracelular. În procesul de recunoaștere, opsoninele joacă un rol important, care sunt mediatori în interacțiunea receptorilor fagocitelor cu microorganismele. Rolul principal în absorbție revine proteinelor contractile care promovează formarea pseudopodiilor. În paralel cu absorbția, are loc în ea formarea de forme active toxice pentru microbi. O 2 - peroxid de hidrogen, radicali hidroxil, anion superoxid (așa-numita explozie respiratorie). Enzima mieloperoxidaza le sporește acțiunea, iar protecția fagocitelor față de acestea este asigurată de superoxid dismutază, catalază și în reacțiile șuntului hexoză monofosfat.
Proliferare
Proliferare(din lat. proliferatio - reproducere). În focarul inflamației, elementele de țesut local se înmulțesc și se maturizează, în principal țesutul conjunctiv (rar epitelial) cu înlocuirea ulterioară a zonei de țesut deteriorat. Etapa finală a proliferării este involuția secundară a cicatricei, când structurile de colagen în exces sunt lizate, îndepărtate și rămâne doar cantitatea necesară pentru finalizarea adecvată a procesului inflamator. Cursul proliferării este controlat de mulți factori:
fibroblastele sintetizează procolagenul și, în același timp, secretă colagenază, care descompune colagenul. Între aceste procese există o interacțiune a tipului de autoreglare. Încălcarea acestui regulament poate duce la dezvoltarea scleropatiilor;
fibroblastele formează fibronectium, care determină migrarea, proliferarea și aderența celulelor țesutului conjunctiv;
macrofagele aflate în stadiul final al inflamației secretă un factor special de stimulare a fibroblastelor care le mărește reproducerea și proprietățile adezive;
celulele mononucleare din sânge ale animalelor și păsărilor secretă limfokine și monokine care inhibă proliferarea fibroblastelor și formarea colagenului;
macrofagele secretă prostaglandine din grupa E, care pot potența creșterea prin creșterea aportului de sânge către țesutul în regenerare;
neutrofilele sunt capabile să producă inhibitori specifici țesuturilor - kaloni și antikeyloni - stimulatori de proliferare care interacționează într-o manieră de feedback;
corticosteroizi: glucocorticoizii inhibă regenerarea, reduc sensibilitatea macrofagelor la limfokine și astfel inhibă secreția de colagen; mineralocorticoizii stimulează procesul de regenerare;
nucleotide ciclice: cAMP inhibă activitatea mitotică a celulelor; cGMP, dimpotrivă, este un stimulator al proliferării.
Informatii generale
Inflamaţie- o reacție locală complexă vascular-mezenchimală la afectarea tisulară cauzată de acțiunea diferiților agenți. Această reacție are ca scop distrugerea agentului care a cauzat deteriorarea și repararea țesutului deteriorat. Inflamația, o reacție dezvoltată în cursul filogenezei, are un caracter protector și adaptativ și poartă elemente nu numai de patologie, ci și de fiziologie. O astfel de semnificație dublă pentru organismul inflamației este o caracteristică particulară a acesteia.
De asemenea, în sfârşitul XIX-lea secolul I.I. Mechnikov credea că inflamația este o reacție adaptativă a organismului dezvoltată în cursul evoluției, iar una dintre cele mai importante manifestări ale acesteia este fagocitoza de către microfage și macrofage a agenților patogeni și astfel asigurând recuperarea organismului. Dar funcția reparatorie a inflamației a fost pentru I.I. Mechnikov este ascuns. Subliniind caracterul protector al inflamației, el credea în același timp că puterea de vindecare a naturii, care este reacția inflamatorie, nu este încă o adaptare care a ajuns la perfecțiune. Potrivit lui I.I. Mechnikov, dovada acestui lucru sunt bolile frecvente însoțite de inflamație și decesele cauzate de acestea.
Etiologia inflamației
Factorii care provoacă inflamația pot fi biologici, fizici (inclusiv traumatici), chimici; sunt de origine endogene sau exogene.
La factori fizici, provoacă inflamație, includ radiații și energie electrică, temperaturi ridicate și scăzute, diferite tipuri de leziuni.
factori chimici inflamația poate fi o varietate de substanțe chimice, toxine și otrăvuri.
Dezvoltarea inflamației este determinată nu numai de influența unuia sau altuia factor etiologic, ci și de particularitatea reactivității organismului.
Morfologia și patogeneza inflamației
Inflamaţie poate fi exprimat prin formarea unui focar microscopic sau a unei zone extinse, au nu numai un caracter focal, ci și difuz. Uneori, inflamația apare în sistemul de țesuturi, apoi vorbește despre sistemică leziuni inflamatorii (boli reumatice cu leziuni inflamatorii sistemice ale țesutului conjunctiv, vasculite sistemice etc.). Uneori trasați o linie între localizat și sistemic proces inflamator se întâmplă să fie dificil.
În zonă se dezvoltă inflamația histion şi constă din următoarele faze care se dezvoltă succesiv: 1) alterare; 2) exudație; 3) proliferarea celulelor hematogene și histiogene și, mai rar, a celulelor parenchimatoase (epiteliu). Relația dintre aceste faze este prezentată în Schema IX.
Modificare- afectarea țesuturilor este faza initiala inflamație și se manifestă prin diferite tipuri de distrofie și necroză. În această fază a inflamației, are loc o eliberare de substanțe biologic active - mediatori inflamatori. Aceasta - lansator inflamație, care determină cinetica răspunsului inflamator.
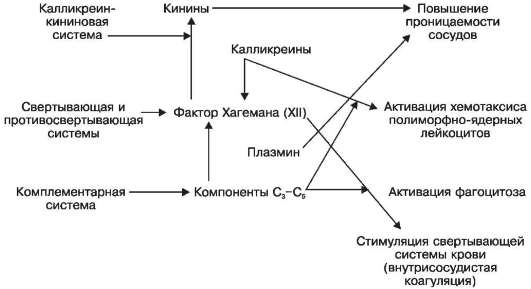
Mediatorii inflamatori pot fi de origine plasmatică (umorală) și celulară (țesut). Mediatori de origine plasmatică- sunt reprezentanți ai sistemelor kalikrein-kinină (kinine, kalikreine), coagulare și anticoagulare (factorul XII de coagulare a sângelui, sau factor Hageman, plasmină) și complementare (componentele C 3 -C 5). Mediatorii acestor sisteme cresc permeabilitatea microvaselor, activează chemotaxia leucocitelor polimorfonucleare, fagocitoza și coagularea intravasculară (Schema X).
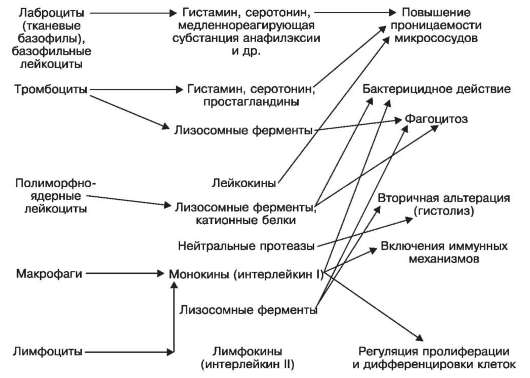
Mediatori de origine celulară asociat cu celule efectoare - mastocite (bazofile tisulare) și leucocite bazofile, care eliberează histamina, serotonina, o substanță de anafilaxie care reacţionează lent etc.; trombocitele producând, pe lângă histamina, serotonină și prostaglandine, și enzime lizozomale; leucocite polimorfonucleare bogate în leucokine
Schema IX. Fazele inflamației
Schema X. Acțiunea mediatorilor inflamatori de origine plasmatică (umorală).
 mi, enzime lizozomale, proteine cationice și proteaze neutre. Celulele efectoare care produc mediatori inflamatori sunt, de asemenea, celule ale reacțiilor imune - macrofage care își eliberează monokinele (interleukina I) și limfocitele care produc limfokine (interleukina II). Nu numai că este asociat cu mediatori de origine celulară permeabilitate crescută a microvaselor
și fagocitoză;
ei au acțiune bactericidă,
cauză alterare secundară
(histoliză), includ mecanisme imunitare
într-un răspuns inflamator reglementează proliferarea
și diferențierea celulară
pe domeniul inflamației, care vizează repararea, compensarea sau înlocuirea focarului de afectare cu țesut conjunctiv (Schema XI). Conductorul interacțiunilor celulare în domeniul inflamației este macrofage.
mi, enzime lizozomale, proteine cationice și proteaze neutre. Celulele efectoare care produc mediatori inflamatori sunt, de asemenea, celule ale reacțiilor imune - macrofage care își eliberează monokinele (interleukina I) și limfocitele care produc limfokine (interleukina II). Nu numai că este asociat cu mediatori de origine celulară permeabilitate crescută a microvaselor
și fagocitoză;
ei au acțiune bactericidă,
cauză alterare secundară
(histoliză), includ mecanisme imunitare
într-un răspuns inflamator reglementează proliferarea
și diferențierea celulară
pe domeniul inflamației, care vizează repararea, compensarea sau înlocuirea focarului de afectare cu țesut conjunctiv (Schema XI). Conductorul interacțiunilor celulare în domeniul inflamației este macrofage.
Mediatorii de origine plasmă și celulară sunt interconectați și funcționează pe principiul unei reacții autocatalitice cu feedback și sprijin reciproc (vezi Schemele X și XI). Acțiunea mediatorilor este mediată de receptorii de pe suprafața celulelor efectoare. De aici rezultă că schimbarea în timp a unor mediatori de către alții determină o modificare a formelor celulare în domeniul inflamației - de la un leucocit polimorfonuclear pentru fagocitoză la un fibroblast activat de monokinele macrofagelor pentru reparare.
Exudația- faza care urmeaza rapid alterarea si eliberarea neurotransmitatorilor. Constă dintr-un număr de etape: reacția patului microcirculator cu încălcări ale proprietăților reologice ale sângelui; permeabilitate vasculară crescută la nivelul microvasculaturii; exudarea componentelor plasmei sanguine; emigrarea celulelor sanguine; fagocitoză; formarea de exudat și infiltrat de celule inflamatorii.
Schema XI. Acțiunea mediatorilor inflamatori de origine celulară (tisulară).
nia
 Reacția patului de microcirculație cu încălcări ale proprietăților reologice ale sângelui- unul dintre cele mai strălucitoare semne morfologice ale inflamației. Modificările microvaselor încep cu un spasm reflex, o scădere a lumenului arteriolelor și precapilarelor, care este rapid înlocuită cu o extindere a întregii rețele vasculare a zonei de inflamație și, mai ales, postcapilare și venule. Hiperemia inflamatorie determină creșterea temperaturii (calor)și roșeață (rubor) zona inflamata. Cu un spasm inițial, fluxul de sânge în arteriole devine accelerat și apoi încetinit. În vasele limfatice, ca și în vasele de sânge, fluxul limfatic se accelerează mai întâi, apoi încetinește. Vasele limfatice debordează cu limfă și leucocite.
Reacția patului de microcirculație cu încălcări ale proprietăților reologice ale sângelui- unul dintre cele mai strălucitoare semne morfologice ale inflamației. Modificările microvaselor încep cu un spasm reflex, o scădere a lumenului arteriolelor și precapilarelor, care este rapid înlocuită cu o extindere a întregii rețele vasculare a zonei de inflamație și, mai ales, postcapilare și venule. Hiperemia inflamatorie determină creșterea temperaturii (calor)și roșeață (rubor) zona inflamata. Cu un spasm inițial, fluxul de sânge în arteriole devine accelerat și apoi încetinit. În vasele limfatice, ca și în vasele de sânge, fluxul limfatic se accelerează mai întâi, apoi încetinește. Vasele limfatice debordează cu limfă și leucocite.
În țesuturile avasculare (cornee, valve cardiace), la începutul inflamației, predomină fenomenele de alterare, iar apoi vasele din zonele învecinate cresc (aceasta se întâmplă foarte repede) și sunt incluse în reacția inflamatorie.
Modificări ale proprietăților reologice ale sângelui consta in faptul ca in venule si postcapilare dilatate cu flux sanguin lent, distributia leucocitelor si eritrocitelor in fluxul sanguin este perturbata. Leucocitele polimorfonucleare (neutrofile) ies din curentul axial, se adună în zona marginală și sunt situate de-a lungul peretelui vasului. margine-
intregul aranjament al neutrofilelor este inlocuit cu lor marginea în picioare, care precede emigrareîn afara vasului.
Modificări ale hemodinamicii și tonusului vascular în focarul inflamației duc la stazăîn postcapilare și venule, care este înlocuită tromboză. Aceleași modificări apar și în vasele limfatice. Astfel, odată cu fluxul continuu de sânge în focarul inflamației, ieșirea acestuia, precum și limfa, sunt perturbate. Blocarea vaselor de sânge și limfatice eferente permite focalizării inflamației să acționeze ca o barieră care împiedică generalizarea procesului.
Creșterea permeabilității vasculare la nivelul microvasculaturii este unul dintre semnele esențiale ale inflamației. Întreaga gamă de modificări tisulare, originalitatea formelor de inflamație sunt în mare măsură determinate de starea de permeabilitate vasculară, de adâncimea leziunii sale. Un rol important în implementarea permeabilității crescute a vaselor microvasculare aparține ultrastructurilor celulare deteriorate, ceea ce duce la micropinocitoză crescută. asociat cu permeabilitate vasculară crescută exudarea în țesuturi și cavități a părților lichide ale plasmei, emigrarea celulelor sanguine, educaţie exudat(revărsat inflamator) și infiltrat celular inflamator.
Exudația părțile constitutive plasmă sângele este considerat ca o manifestare a unei reacții vasculare care se dezvoltă în patul de microcirculație. Se exprimă în ieșirea din vas a componentelor lichide ale sângelui: apă, proteine, electroliți.
Emigrarea celulelor sanguine acestea. ieșirea lor din fluxul sanguin prin peretele vaselor de sânge se realizează cu ajutorul mediatorilor chemotactici (vezi Schema X). După cum sa menționat deja, emigrarea este precedată de situația marginală a neutrofilelor. Ele aderă la peretele vasului (în principal în postcapilare și venule), apoi formează procese (pseudopodia) care pătrund între celulele endoteliale - emigrarea interendotelială(Fig. 63). Neutrofilele traversează membrana bazală, cel mai probabil pe baza fenomenului tixotropie(tixotropie - scăderea izometrică reversibilă a vâscozității coloizilor), adică. trecerea gelului membranar la sol atunci când celula atinge membrana. În țesutul perivascular, neutrofilele își continuă mișcarea cu ajutorul pseudopodelor. Procesul de migrare a leucocitelor se numește leucodiapedeză,și eritrocite - eritrodiapedeză.
Fagocitoză(din greaca. phagos- devoreaza si kitos- receptacul) - absorbția și digestia de către celule (fagocite) a diverselor corpuri atât de natură vii (bacterii), cât și neînsuflețite (corpi străini). Fagocitele pot fi o varietate de celule, dar în inflamație, neutrofilele și macrofagele sunt de cea mai mare importanță.
Fagocitoza este asigurată de o serie de reacții biochimice. În timpul fagocitozei, conținutul de glicogen din citoplasma fagocitei scade, ceea ce este asociat cu glicogenoliza anaerobă îmbunătățită, care este necesară pentru a genera energie pentru fagocitoză; substanțele care blochează glicogenoliza inhibă și fagocitoza.
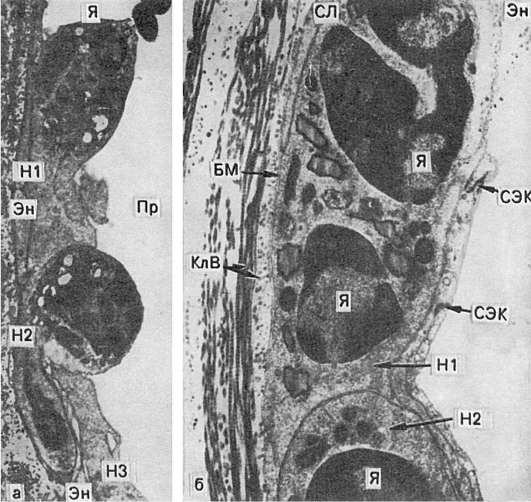 Orez. 63. Emigrarea leucocitelor prin peretele vasului în timpul inflamației:
Orez. 63. Emigrarea leucocitelor prin peretele vasului în timpul inflamației:
a - unul dintre neutrofile (H1) este aproape adiacent endoteliului (En), celălalt (H2) are un nucleu bine definit (N) și pătrunde în endoteliu (En). Majoritatea acestor leucocite sunt localizate în stratul subendotelial. Pe endoteliul din această zonă sunt vizibile pseudopode ale celui de-al treilea leucocit (H3); Pr - lumenul vasului. x9000; b - neutrofilele (SL) cu nuclei bine conturați (N) sunt situate între endoteliu și membrana bazală (BM); joncțiunile celulelor endoteliale (ECC) și fibrelor de colagen (CLF) din spatele membranei bazale. x20.000 (conform Flory și Grant)
Se formează un obiect fagocitar (bacterie) înconjurat de o citomembrană invaginată (fagocitoză - pierderea citomembranei fagocitare). fagozom. Când fuzionează cu un lizozom, fagolizozom(lizozom secundar), în care digestia intracelulară se realizează cu ajutorul enzimelor hidrolitice - fagocitoză finalizată(Fig. 64). În fagocitoza completă, proteinele cationice antibacteriene ale lizozomilor neutrofili joacă un rol important; ele ucid microbii, care sunt apoi digerați. În cazurile în care microorganismele nu sunt digerate de fagocite, mai des de macrofage și se înmulțesc în citoplasma lor, ele vorbesc despre fagocitoză incompletă, sau endocitobioza. A lui
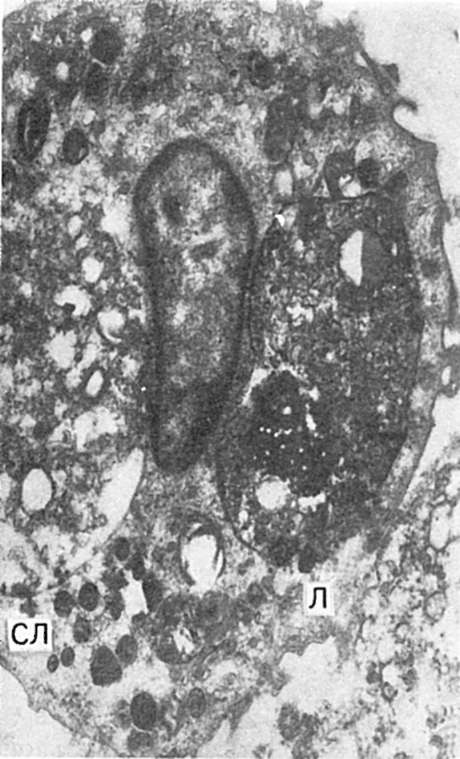 Orez. 64. Fagocitoză. Macrofag cu fragmente de leucocite fagocitate (SL) și incluziuni lipidice (L). electronogramă. x 20.000.
Orez. 64. Fagocitoză. Macrofag cu fragmente de leucocite fagocitate (SL) și incluziuni lipidice (L). electronogramă. x 20.000.
explicată din multe motive, în special, prin faptul că lizozomii macrofagilor pot conține o cantitate insuficientă de proteine cationice antibacteriene sau sunt complet lipsiți de ele. Astfel, fagocitoza nu este întotdeauna o reacție de protecție a organismului și uneori creează premisele pentru diseminarea microbilor.
Formarea de exudat și infiltrat de celule inflamatorii completează procesele de exudare descrise mai sus. Exudarea părților lichide ale sângelui, emigrarea leucocitelor, diapedeza eritrocitelor duc la apariția în țesuturile sau cavitățile corpului afectate a unui lichid inflamator - exudat. Acumularea de exudat în țesut duce la creșterea volumului acestuia (tumoare) compresie nervoasă și durere (dolor), a cărui apariție în timpul inflamației este, de asemenea, asociată cu influența mediatorilor (bradikinina), la o încălcare a funcției unui țesut sau organ (functio laesa).
De obicei, exudatul conține mai mult de 2% proteine. În funcție de gradul de permeabilitate a peretelui vasului, diferite proteine pot pătrunde în țesut. Cu o ușoară creștere a permeabilității barierei vasculare, prin aceasta pătrund în principal albuminele și globulinele și, cu un grad ridicat de permeabilitate, proteinele moleculare mari, în special fibrinogenul, ies și ele împreună cu acestea. În unele cazuri, neutrofilele predomină în exudat, în altele - limfocite, monocite și histiocite, în altele - eritrocite.
Odată cu acumularea de celule exsudate în țesuturi, și nu partea sa lichidă, se vorbește despre infiltrat de celule inflamatorii,în care pot predomina atât elementele hematogene cât şi cele histiogene.
Proliferare(reproducția) celulelor este faza finală a inflamației, care vizează refacerea țesutului deteriorat. Numărul de celule cambiale mezenchimale, limfocite B și T și monocite crește. Când celulele se înmulțesc în focarul inflamației, se observă diferențierea și transformarea celulelor (Schema XII): celulele mezenchimale cambiale se diferențiază în fibroblaste; limfocitele B
Schema XII. Diferențierea și transformarea celulelor în timpul inflamației
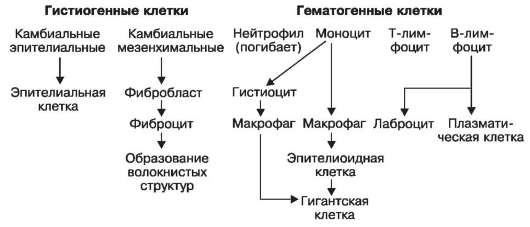 da naștere la educație celule plasmatice. Limfocitele T, aparent, nu se transformă în alte forme. Monocitele dau naștere histiociteși macrofage. Macrofagele pot fi o sursă de educație epitelioidși celule gigantice(celule de corpuri străine și Pirogov-Langhans).
da naștere la educație celule plasmatice. Limfocitele T, aparent, nu se transformă în alte forme. Monocitele dau naștere histiociteși macrofage. Macrofagele pot fi o sursă de educație epitelioidși celule gigantice(celule de corpuri străine și Pirogov-Langhans).
În diferite stadii de proliferare a fibroblastelor, produse activitățile lor – proteine colagenși glicozaminoglicani, apărea argirofilși fibre de colagen, substanță intercelularățesut conjunctiv.
În procesul de proliferare în timpul inflamației, este, de asemenea, implicat epiteliu(vezi Schema XII), care este deosebit de pronunțată la nivelul pielii și mucoaselor (stomac, intestine). În acest caz, epiteliul în proliferare poate forma excrescențe polipe. Proliferarea celulară în domeniul inflamației servește drept reparație. În același timp, diferențierea structurilor epiteliale proliferante este posibilă numai cu maturarea și diferențierea țesutului conjunctiv (Garshin V.N., 1939).
Inflamația cu toate componentele sale apare numai în etapele ulterioare ale dezvoltării fetale. La făt, nou-născut și copil, inflamația are o serie de caracteristici. Prima caracteristică a inflamației este predominarea componentelor sale alternative și productive, deoarece acestea sunt mai vechi din punct de vedere filogenetic. A doua caracteristică a inflamației asociate cu vârsta este tendința procesului local de răspândire și generalizare din cauza imaturității anatomice și funcționale a organelor de imunogeneză și a țesuturilor de barieră.
Reglarea inflamației efectuată cu ajutorul factorilor hormonali, nervoși și imunitari. S-a stabilit că unii hormoni, precum hormonul somatotrop (GH) al glandei pituitare, deoxicorticosteronul, aldosteronul, cresc răspunsul inflamator. (hormoni proinflamatori) altele - glucocorticoizii și hormonul adrenocorticotrop (ACLT) al glandei pituitare, dimpotrivă, o reduc (hormoni antiinflamatori). substanțe colinergice, prin stimularea eliberării mediatorilor inflamatori,
acționează ca hormonii proinflamatori și adrenergic, inhibă activitatea mediatorului, se comportă ca hormonii antiinflamatori. Severitatea reacției inflamatorii, rata dezvoltării și natura acesteia sunt afectate de starea de imunitate. Inflamația decurge mai ales rapid în condiții de stimulare antigenică (sensibilizare); în astfel de cazuri se vorbeşte despre imun, sau alergică, inflamație(vezi Procese imunopatologice).
Exod inflamația este diferită în funcție de etiologia sa și de natura cursului, de starea corpului și de structura organului în care se dezvoltă. Produsele de degradare a țesuturilor suferă clivaj enzimatic și resorbție fagocitară, are loc resorbția produselor de descompunere. Datorită proliferării celulare, focarul inflamației este înlocuit treptat de celulele țesutului conjunctiv. Dacă focarul inflamației a fost mic, poate apărea restaurarea completă a țesutului anterior. Cu un defect tisular semnificativ, se formează o cicatrice la locul focalizării.
Terminologia și clasificarea inflamației
În cele mai multe cazuri, numele inflamației unui anumit țesut (organ) este de obicei compus prin adăugarea finalului la numele latin și grecesc al organului sau țesutului. -este, iar la rusă - -it. Deci, inflamația pleurei este desemnată ca pleurită- pleurezie, inflamație a rinichilor - nefrită- nefrită, inflamație a gingiilor - gingivita- gingivita etc. Inflamația unor organe are denumiri speciale. Deci, inflamația faringelui se numește angină (din greacă. ancho- suflet, stoarcere), pneumonie - pneumonie, inflamație a unui număr de cavități cu acumulare de puroi în ele - empiem (de exemplu, empiem al pleurei), inflamație purulentă a foliculului de păr cu glanda și țesuturile sebacee adiacente - furuncul (din lat. furiare- înfurie), etc.
Clasificare. Se ține cont de natura cursului procesului și de formele morfologice, în funcție de predominanța fazei exsudative sau proliferative a inflamației. După natura fluxului, ele disting inflamație acută, subacută și cronică, prin predominarea fazei exudative sau proliferative a reacţiei inflamatorii - exudativ şi.
Până de curând, printre formele morfologice de inflamație, inflamație alternativă,în care predomină alterarea (inflamația necrotică), iar exsudația și proliferarea sunt extrem de slabe sau deloc exprimate. În prezent, existența acestei forme de inflamație este negata de majoritatea patologilor pe motiv că în așa-numita inflamație alternativă nu există, în esență, o reacție vascular-mezenchimală (exudație și proliferare), care este esența reacției inflamatorii. Astfel, în acest caz, nu vorbim despre inflamaţie oh oh necroză. Conceptul de inflamație alternativă a fost creat de R. Virchow, care a pornit de la „teoria sa nutritivă” a inflamației (s-a dovedit a fi eronată), așa că a numit inflamație alternativă parenchimatoase.
Forme morfologice de inflamație
Inflamație exudativă
Inflamație exudativă caracterizat prin predominanţa exsudaţiei şi formarea de exudat în ţesuturi şi cavităţile corpului. În funcție de natura exudatului și de localizarea predominantă a inflamației, se disting următoarele tipuri de inflamație exsudativă: 1) seroasă; 2) fibrinos; 3) purulent; 4) putred; 5) hemoragic; 6) cataral; 7) mixt.
Inflamație seroasă. Se caracterizează prin formarea de exudat care conține până la 2% proteine și o cantitate mică de elemente celulare. Cursul inflamației seroase este de obicei acut. Apare mai des în cavitățile seroase, mucoase și meninge, mai rar în organele interne, piele.
Tabloul morfologic. LA cavități seroase se acumulează exudat seros - un lichid tulbure, sărac în elemente celulare, printre care predomină celulele mezoteliale dezumflate și neutrofilele singulare; scoicile devin pline de sânge. Aceeași imagine reiese pentru meningita seroasa. Cu inflamație membrana mucoasă, care devin, de asemenea, cu sânge, mucusul și celulele epiteliale dezumflate sunt amestecate cu exudatul, catar seros membrana mucoasă (vezi descrierea catarului mai jos). LA ficat fluidul se acumulează în spațiile perisinusoidale (Fig. 65), în miocardului între fibrele musculare în rinichi - în lumenul capsulei glomerulare. Inflamație seroasă piele, de exemplu, cu o arsură, se exprimă prin formarea de vezicule care apar în grosimea epidermei, umplute cu un revărsat tulbure. Uneori, exudatul se acumulează sub epidermă și îl exfoliază din țesutul subiacent cu formarea de vezicule mari.
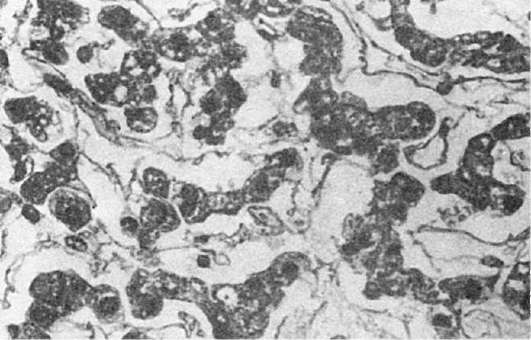 Orez. 65. Hepatită seroasă
Orez. 65. Hepatită seroasă
Cauză inflamația seroasă sunt diverși agenți infecțioși (mycobacterium tuberculosis, diplococul Frenkel, meningococul, shigella), expunerea la factori termici și chimici, autointoxicarea (de exemplu, cu tireotoxicoză, uremie).
Exod inflamația seroasă este de obicei favorabilă. Chiar și o cantitate semnificativă de exsudat poate fi absorbită. În organele interne (ficat, inimă, rinichi), scleroza se dezvoltă uneori ca urmare a inflamației seroase în cursul său cronic.
Sens determinată de gradul de afectare funcţională. În cavitatea cămășii inimii, efuziunea împiedică activitatea inimii, în cavitatea pleurală duce la colapsul (comprimarea) plămânului.
inflamație fibrinoasă. Se caracterizează prin formarea unui exudat bogat în fibrinogen, care în țesutul afectat (necrotic) se transformă în fibrină. Acest proces este facilitat de eliberarea unei cantități mari de tromboplastină în zona de necroză. Inflamația fibrinoasă este localizată în membranele mucoase și seroase, mai rar în grosimea organului.
Tabloul morfologic. Pe suprafața membranei mucoase sau seroase apare o peliculă gri-albicioasă (inflamație „membranoasă”). În funcție de adâncimea necrozei tisulare, de tipul de epiteliu al membranei mucoase, pelicula poate fi conectată lejer cu țesuturile subiacente și, prin urmare, poate fi ușor separată sau ferm și, prin urmare, dificil de separat. În primul caz, se vorbește despre crupus, iar în al doilea - despre varianta difterică a inflamației fibrinoase.
Inflamație crupoasă(din scotia. a decupa- film) apare cu necroza tisulara superficiala si impregnarea maselor necrotice cu fibrina (Fig. 66). Filmul, vag asociat cu țesutul subiacent, face ca membrana mucoasă sau seroasă să fie plictisitoare. Uneori pare că coaja este, parcă, stropită cu rumeguș. membrană mucoasă se îngroașă, se umflă, dacă filmul este separat, apare un defect de suprafață. Membrana seroasă devine aspră, parcă acoperită cu fire de păr - fibrină. Cu pericardită fibrinoasă în astfel de cazuri, se vorbește despre o „inimă păroasă”. Printre organele interne, inflamația croupoasă se dezvoltă în plămâni - pneumonie croupoasă (vezi. pneumonie).
Inflamație difterică(din greaca. diftere- peliculă piele) se dezvoltă cu necroză tisulară profundă şi impregnarea maselor necrotice cu fibrină (Fig. 67). Se dezvoltă pe membrana mucoasă. Filmul fibrinos este strâns lipit de țesutul subiacent; atunci când este respins, apare un defect profund.
Varianta de inflamație fibrinoasă (cropoasă sau difterică) depinde, după cum sa menționat deja, nu numai de profunzimea necrozei tisulare, ci și de tipul de epiteliu care căptușește mucoasele. Pe membranele mucoase acoperite cu epiteliu scuamos (cavitatea bucală, faringe, amigdale, epiglotă, esofag, adevărate corzi vocale, col uterin), filmele sunt de obicei strâns asociate cu epiteliul, deși necroza și prolapsul fibrinei sunt uneori limitate doar la capacul epitelial. Asta explica-
 Se datorează faptului că celulele epiteliului scuamos sunt strâns legate între ele și cu țesutul conjunctiv subiacent și, prin urmare, „țin ferm” filmul. În mucoasele acoperite cu epiteliu prismatic (tractul respirator superior, tractul gastro-intestinal etc.), legătura epiteliului cu țesutul dedesubt este slăbită, astfel încât filmele rezultate sunt ușor separate împreună cu epiteliul chiar și cu precipitarea profundă a fibrinei. Semnificația clinică a inflamației fibrinoase, de exemplu, în faringe și trahee este inegală chiar și cu aceeași cauză a apariției acesteia (durere în gât difteric și traheită croupoasă în difterie).
Se datorează faptului că celulele epiteliului scuamos sunt strâns legate între ele și cu țesutul conjunctiv subiacent și, prin urmare, „țin ferm” filmul. În mucoasele acoperite cu epiteliu prismatic (tractul respirator superior, tractul gastro-intestinal etc.), legătura epiteliului cu țesutul dedesubt este slăbită, astfel încât filmele rezultate sunt ușor separate împreună cu epiteliul chiar și cu precipitarea profundă a fibrinei. Semnificația clinică a inflamației fibrinoase, de exemplu, în faringe și trahee este inegală chiar și cu aceeași cauză a apariției acesteia (durere în gât difteric și traheită croupoasă în difterie).
Motivele inflamațiile fibrinoase sunt diferite. Poate fi cauzată de diplococi Frenkel, streptococi și stafilococi, agenți patogeni ai difteriei și dizenteriei, mycobacterium tuberculosis și virusurile gripale. Pe lângă agenții infecțioși, inflamația fibrinoasă poate fi cauzată de toxine și otrăvuri de origine endogenă (de exemplu, cu uremie) sau exogenă (cu otrăvire sublimată).
curgere inflamația fibrinoasă este de obicei acută. Uneori (de exemplu, cu tuberculoza membranelor seroase), este cronică.
Exod inflamația fibrinoasă a membranelor mucoase și seroase nu este aceeași. Pe membranele mucoase, după respingerea filmelor, rămân defecte de diferite adâncimi - ulcere; cu inflamație croupoasă, sunt superficiale, cu difterie - profundă și lasă în urmă modificări cicatriciale. Pe membranele seroase este posibilă resorbția exudatului fibrinos. Cu toate acestea, masele de fibrină suferă adesea organizare, ceea ce duce la formarea de aderențe între foile seroase ale pleurei, peritoneului și cămașa cardiacă. În rezultatul inflamației fibrinoase, poate apărea o creștere excesivă completă a cavității seroase cu țesut conjunctiv - aceasta obliterarea.
Sens inflamația fibrinoasă este foarte mare, deoarece formează baza morfologică a multor boli (difterie, dizenterie),
observată cu intoxicaţie (uremie). Odată cu formarea de filme în laringe, trahee, există pericolul de asfixie; cu respingerea filmelor în intestin, este posibilă sângerare din ulcerele rezultate. După ce a suferit o inflamație fibrinoasă, pot rămâne ulcere cicatrici pe termen lung, nevindecatoare.
Inflamație purulentă. Se caracterizează prin predominanța neutrofilelor în exsudat. Neutrofile în descompunere, care se numesc corpuri purulente,împreună cu partea lichidă a exsudatului formează puroi. De asemenea, conține limfocite, macrofage, celule moarte ale țesuturilor, microbi. Puroiul este un lichid tulbure, gros, care are o culoare galben-verzuie. O trăsătură caracteristică a inflamației purulente este histoliza, datorită efectului asupra țesuturilor enzimelor proteolitice ale neutrofilelor. Inflamația purulentă apare în orice organ, orice țesut.
Tabloul morfologic. Inflamația purulentă, în funcție de prevalența ei, poate fi reprezentată de un abces sau flegmon.
abces (abces)- inflamație purulentă focală, caracterizată prin formarea unei cavități umplute cu puroi (Fig. 68). În timp, abcesul este delimitat de un arbore de țesut de granulație, bogat în capilare, prin ai cărui pereți are loc o emigrare crescută a leucocitelor. Format ca și cum învelișul abcesului. În exterior, este format din fibre de țesut conjunctiv care sunt adiacente țesutului neschimbat, iar în interior - țesut de granulație și puroi, care este reînnoit continuu datorită eliberării de corpuri purulente prin granulații. Abcesul care produce puroi se numește membrana piogenă.
Flegmon - inflamație purulentă difuză, în care exudatul purulent se răspândește difuz între elementele tisulare, impregnând, exfoliând și lizand țesuturile. Cel mai adesea, flegmonul este observat acolo unde exudatul purulent își poate face ușor drum, adică. de-a lungul straturilor intermusculare, de-a lungul tendoanelor, fasciei, în țesutul subcutanat, de-a lungul trunchiurilor neurovasculare etc.
Există flegmoni moi și tari. Flegmon moale caracterizată prin absența focarelor vizibile de necroză tisulară, flegmon dur- prezența unor astfel de focare care nu suferă fuziune purulentă, în urma căreia țesutul devine foarte dens; țesutul mort este îndepărtat. Flegmo-
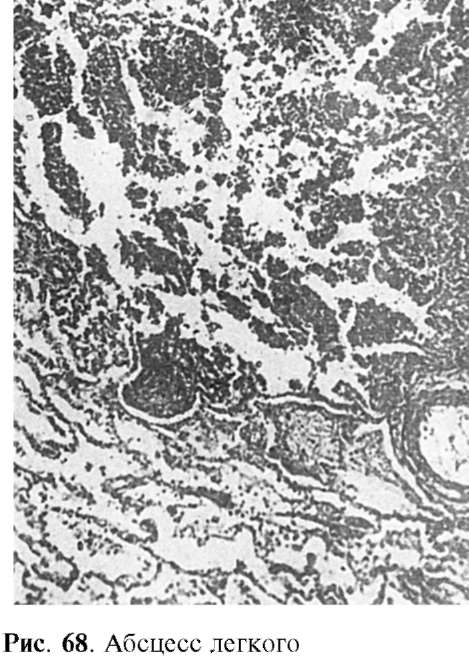 pe tesutul adipos (celulita) se caracterizeaza prin distributie nelimitata. Poate exista o acumulare de puroi în cavitățile corpului și în unele organe goale, care se numește empiem
(empiem al pleurei, vezicii biliare, apendice etc.).
pe tesutul adipos (celulita) se caracterizeaza prin distributie nelimitata. Poate exista o acumulare de puroi în cavitățile corpului și în unele organe goale, care se numește empiem
(empiem al pleurei, vezicii biliare, apendice etc.).
Cauză inflamația purulentă sunt mai des microbi piogeni (stafilococ, streptococ, gonococi, meningococi), mai rar diplococi Frenkel, bacili tifoizi, mycobacterium tuberculosis, ciuperci etc. Inflamația purulentă aseptică este posibilă atunci când anumite substanțe chimice intră în țesut.
curgere inflamația purulentă poate fi acută și cronică. Inflamație purulentă acută, reprezentat de un abces sau flegmon, tinde să se răspândească. Ulcerele, care topesc capsula organului, se pot sparge în cavitățile învecinate. Între abces și cavitatea în care a spart puroiul, există pasaje fistuloase.În aceste cazuri, este posibil să se dezvolte empiem. Inflamația purulentă, atunci când se răspândește, trece la organele și țesuturile învecinate (de exemplu, pleurezia apare cu un abces pulmonar, iar peritonita apare cu un abces hepatic). Cu un abces și flegmon, se poate obține un proces purulent limfogenși răspândire hematogenă, care duce la dezvoltare septicopiemie(cm. Septicemie).
Inflamație cronică supurată se dezvoltă atunci când abcesul este încapsulat. În același timp, scleroza se dezvoltă în țesuturile din jur. Dacă puroiul în astfel de cazuri găsește o cale de ieșire, apare pasaje fistuloase cronice, sau fistule, care se deschid prin piele spre exterior. Dacă pasajele fistuloase nu se deschid și procesul continuă să se răspândească, abcesele pot apărea la o distanță considerabilă de focarul primar al inflamației purulente. Astfel de ulcere îndepărtate sunt numite abces sinterizat, sau bazin. Cu un curs lung, inflamația purulentă se răspândește prin fibrele libere și formează dungi extinse de puroi, provocând intoxicație severă și ducând la epuizarea corpului. În rănile complicate de supurația plăgii, a epuizarea ranilor, sau febră purulent-resorbtivă(Davydovsky I.V., 1954).
Exod inflamația purulentă depinde de prevalența sa, de natura cursului, de virulența microbilor și de starea organismului. În cazurile adverse, poate apărea generalizarea infecției, se dezvoltă sepsis. Dacă procesul este delimitat, abcesul este deschis spontan sau chirurgical, ceea ce duce la eliberarea de puroi. Cavitatea abcesului este umplută cu țesut de granulație, care se maturizează și se formează o cicatrice în locul abcesului. Este posibil și un alt rezultat: puroiul din abces se îngroașă, se transformă în detritus necrotic, care suferă pietrificare. Inflamația purulentă prelungită duce adesea la amiloidoza.
Sens Inflamația purulentă este determinată în primul rând de capacitatea sa de a distruge țesuturile (histoliză), ceea ce face posibilă răspândirea procesului purulent prin contact, limfogen și hematogen.
cale. Inflamația purulentă stă la baza multor boli, precum și a complicațiilor acestora.
Inflamație putridă(gangrenos, ichorus, din greacă. sângele zeilor- icor). De obicei, se dezvoltă ca urmare a pătrunderii bacteriilor putrefactive în locul inflamației, provocând descompunerea țesuturilor cu formarea de gaze urât mirositoare.
Inflamație hemoragică. Apare atunci când exudatul conține o mulțime de globule roșii. În dezvoltarea acestui tip de inflamație, rolul nu este doar al unei permeabilitati puternic crescute a microvaselor, ci și al chimiotaxiei negative în raport cu neutrofilele. Inflamația hemoragică apare în boli infecțioase severe - antrax, ciumă, gripă etc. Uneori există atât de multe celule roșii din sânge încât exudatul seamănă cu o hemoragie (de exemplu, cu meningoencefalita cu antrax). Adesea, inflamația hemoragică se alătură altor tipuri de inflamație exudativă.
Rezultatul inflamației hemoragice depinde de cauza care a provocat-o.
Catar(din greaca. catarreo- curgere în jos), sau Qatar. Se dezvoltă pe mucoasele și se caracterizează printr-o eliberare abundentă de exudat la suprafața acestora (Fig. 69). Exudatul poate fi seros, mucos, purulent, hemoragic, iar celulele descuamate ale epiteliului tegumentar sunt întotdeauna amestecate cu acesta. Catarul poate fi acut sau cronic. Catar acut caracteristic unui număr de infecții (de exemplu, catarul acut al tractului respirator superior cu infecție respiratorie acută). În același timp, o schimbare de la un tip de catar la altul este caracteristică - catarul seros este mucos, iar mucosul este purulent sau purulent-hemoragic. Catar cronic apare atât în boli infecțioase (bronșită cronică catarrală purulentă), cât și neinfectioase (gastrita cronică catarrală). Catarul cronic este însoțit de atrofie (catar atrofic) sau hipertrofie (catar hipertrofic) membrană mucoasă.
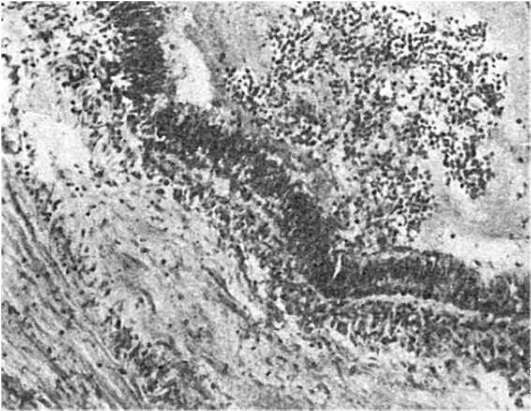 Orez. 69. bronșită catarală
Orez. 69. bronșită catarală
Motivele catarul sunt diferite. Cel mai adesea, catarurile sunt de natură infecțioasă sau infecțioasă-alergică. Se pot dezvolta în timpul autointoxicației (gastrită și colită catarrală uremică), datorită expunerii la agenți termici și chimici.
Sens inflamația catarală este determinată de localizarea sa, intensitatea, natura cursului. Cea mai mare valoare dobândesc cataruri ale mucoaselor tractului respirator, deseori luând un caracter cronic și având consecințe severe (emfizem, pneumoscleroză). Nu mai puțin important este catarul gastric cronic, care contribuie la dezvoltarea unei tumori.
Inflamație mixtă.În acele cazuri când un alt tip de exudat se unește, se observă inflamație mixtă. Apoi se vorbește despre inflamația sero-purulentă, sero-fibrinoasă, purulent-hemoragică sau fibrinos-hemoragică. Mai des, se observă o schimbare a tipului de inflamație exsudativă cu adăugarea unei noi infecții, o schimbare a reactivității corpului.
Inflamație proliferativă (productivă).
Inflamație proliferativă (productivă). caracterizat printr-o predominanţă a proliferării elementelor celulare şi tisulare. Modificările alterative și exsudative trec în fundal. Ca urmare a proliferării celulare, se formează infiltrate celulare focale sau difuze. Pot fi polimorfocelulare, limfocitare monocitare, macrofage, plasmocite, epitelioide, gigantice etc.
Inflamația productivă apare în orice organ, orice țesut. Se disting următoarele tipuri de inflamație proliferativă: 1) interstițială (interstițială); 2) granulomatos; 3) inflamație cu formarea de polipi și veruci genitale.
Inflamație interstițială (interstitială). Se caracterizează prin formarea unui infiltrat celular în stromă - miocard (Fig. 70), ficat, rinichi, plămâni. Infiltratul poate fi reprezentat de histiocite, monocite, limfocite, plasmocite, mastocite, neutrofile simple, eozinofile. Progresia inflamației interstițiale duce la dezvoltarea țesutului conjunctiv fibros matur - se dezvoltă scleroză (vezi Diagrama XII).
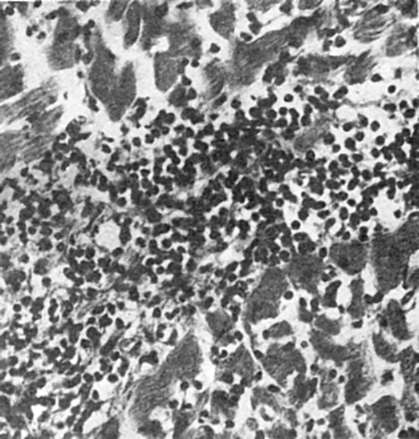 Orez. 70. Miocardită interstițială (interstitială).
Orez. 70. Miocardită interstițială (interstitială).
Dacă există multe plasmocite în infiltratul celular, atunci ele se pot transforma în formațiuni sferice omogene, care se numesc bile hialip, sau corpi fuchsinofili(Corpi Roussel). Extern, organele cu inflamație interstițială se modifică puțin.
Inflamație granulomatoasă. Se caracterizează prin formarea de granuloame (noduli) rezultate din proliferarea și transformarea celulelor capabile de fagocitoză.
Morfogeneza granuloamele constau în 4 etape: 1) acumularea de fagocite monocitare tinere în focarul leziunii tisulare; 2) maturarea acestor celule în macrofage și formarea unui granulom macrofag; 3) maturarea și transformarea fagocitelor și macrofagelor monocitare în celule epitelioide și formarea unui granulom cu celule epitelioide; 4) fuziunea celulelor epitelioide (sau macrofagelor) și formarea celulelor gigantice (celule străine sau celule Pirogov-Langhans) și a celulelor epitelioide sau a granulomului cu celule gigantice. Celulele gigantice sunt caracterizate printr-un polimorfism semnificativ: de la 2-3-nucleare la simplaste gigantice care conțin 100 de nuclei sau mai mult. În celulele gigantice ale corpurilor străine, nucleele sunt distribuite uniform în citoplasmă, în celulele Pirogov-Langhans - în principal de-a lungul periferiei. Diametrul granuloamelor, de regulă, nu depășește 1-2 mm; mai des se găsesc doar la microscop. Rezultatul granulomului este scleroza.
Astfel, ghidat caracteristici morfologice, trebuie distinse trei tipuri de granuloame: 1) granulom macrofag (granulom simplu sau fagocitom); 2) granulom cu celule epitelioide (epiteloidocitom); 3) granulom cu celule gigantice.
În funcție de nivelul metabolismului, granuloamele se disting cu niveluri scăzute și ridicate de metabolism. Granuloame cu rată metabolică scăzută apar atunci când sunt expuse la substanțe inerte (corpi străini inerți) și constau în principal din celule gigantice de corpuri străine. Granuloame cu rată metabolică ridicată apar sub actiunea stimulilor toxici (mycobacterium tuberculosis, lepra etc.) si sunt reprezentate de noduli de celule epitelioide.
Etiologie granulomatoza este variată. Există granuloame infecțioase, neinfecțioase și neidentificate. Granuloame infecțioaseîntâlnit cu tifos și febră tifoidă, reumatism, rabie, encefalită virală, tularemie, bruceloză, tuberculoză, sifilis, lepră, sclerom. Granuloame neinfecțioase apar cu boli de praf (silicoza, talcoza, azbestoza, bisinoza etc.), efectele medicamentoase (hepatita granulomatoasa, boala oleogranulomatoasa); apar si in jurul corpurilor straine. La granuloame de natură necunoscută includ granuloamele în sarcoidoză, bolile Crohn și Horton, granulomatoza Wegener etc. Ghidat după etiologie, în prezent se distinge un grup boli granulomatoase.
Patogeneza granulomatoza este ambiguă. Se știe că sunt necesare două condiții pentru dezvoltarea unui granulom: prezența unor substanțe capabile să stimuleze
lyat sistemul de fagocite monocitare, maturarea și transformarea macrofagelor și rezistența stimulului la fagocite. Aceste condiții sunt percepute în mod ambiguu de către sistemul imunitar. În unele cazuri, un granulom, în celulele epitelioide și gigantice, a cărui activitate fagocitară este redusă brusc, în caz contrar, fagocitoza, este înlocuită cu endocitobioză, devine o expresie. reacții de hipersensibilitate de tip întârziat.În aceste cazuri, se vorbește despre granulom imunitar, care are de obicei o morfologie epitelioid-celulară cu celule gigantice Pirogov-Langhans. În alte cazuri, când fagocitoza în celulele granulomului este relativ suficientă, se vorbește despre granulom non-imun, care este reprezentat de obicei printr-un fagocitom, mai rar printr-un granulom cu celule gigantice, format din celule de corpi straini.
Granuloamele sunt, de asemenea, împărțite în specifice și nespecifice. specific se numesc acele granuloame, a căror morfologie este relativ specifică pentru o anumită boală infecțioasă, al cărei agent cauzal poate fi găsit în celulele granulomului în timpul examenului histobacterioscopic. Granuloamele specifice (anterior erau la baza așa-numitei inflamații specifice) includ granuloamele în tuberculoză, sifilis, lepră și sclerom.
granulom tuberculos are următoarea structură: în centrul ei există un focar de necroză, de-a lungul periferiei - un arbore de celule epitelioide și limfocite cu un amestec de macrofage și celule plasmatice. Între celulele epitelioide și limfocite se află celule gigantice Pirogov-Langhans (Fig. 71, 72), care sunt foarte tipice pentru granulomul tuberculos. Atunci când este impregnat cu săruri de argint, printre celulele granulomului se găsește o rețea de fibre argirofile. Nu număr mare capilarele sanguine se găsesc numai în zonele exterioare
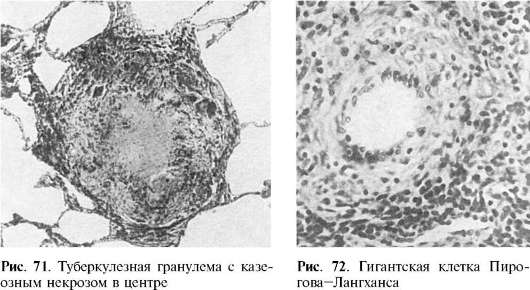 tubercul. Mycobacterium tuberculosis este detectat în celulele gigantice atunci când este colorat conform Ziehl-Neelsen.
tubercul. Mycobacterium tuberculosis este detectat în celulele gigantice atunci când este colorat conform Ziehl-Neelsen.
reprezentat de un focar extins de necroză, înconjurat de un infiltrat celular de limfocite, plasmocite și celule epitelioide; Celulele gigantice Pirogov-Langhans sunt rare (Fig. 73). Gumma se caracterizează prin formarea rapidă a țesutului conjunctiv în jurul focarului de necroză cu multe vase cu endoteliu proliferant (endovasculită). Uneori, în infiltratul celular este posibil să se detecteze treponemul palid prin argint.
Granulom de lepră (leprom) Este reprezentat de un nodul, format în principal din macrofage, precum și din limfocite și plasmocite. Dintre macrofage, se disting celulele mari cu vacuole grase care conțin lepră de micobacterium ambalate sub formă de bile. Aceste celule, foarte caracteristice lepromelor, sunt numite Celulele de lepră ale lui Virchow(Fig. 74). În descompunere, ei eliberează micobacterii, care sunt localizate liber printre celulele lepromei. Numărul de micobacterii din lepromă este enorm. Leproamele se unesc adesea pentru a forma țesut de granulație lepromatos bine vascularizat.
Sclerom granulom este format din plasmă și celule epitelioide, precum și din limfocite, printre care există multe bile hialine. Apariția macrofagelor mari cu o citoplasmă ușoară, numită celule Mikulich.În citoplasmă, agentul cauzal al bolii este detectat - bastoane Volkovich-Frisch (Fig. 75). Scleroza și hialinoza semnificativă a țesutului de granulație sunt, de asemenea, caracteristice.
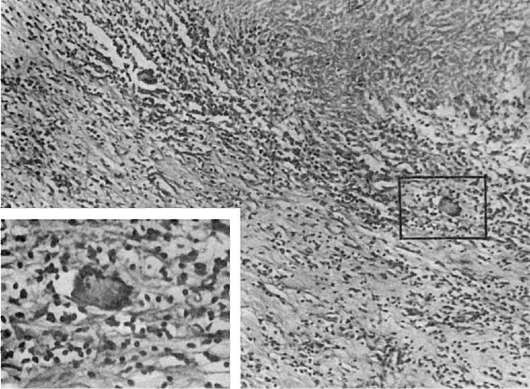 Orez. 73. Granulom sifilitic (guma)
Orez. 73. Granulom sifilitic (guma)
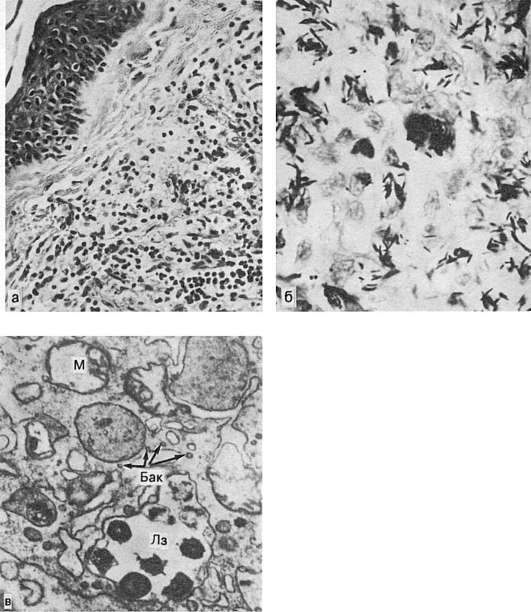 Orez. 74. Lepră:
Orez. 74. Lepră:
a - leproma cu forma lepromatoasa; b - un număr mare de micobacterii în nodul lepros; c - Celula de lepră a lui Virchow. În celulă există acumulări de micobacterii (Buck), un număr mare de lizozomi (Lz); distrugerea mitocondriilor (M). electronogramă. x25.000 (conform lui David)
 Orez. 75. Celula lui Mikulich în sclerom. În citoplasmă (C) sunt vizibile vacuole uriașe, care conțin bacili Volkovich-Frisch (B). PzK - celule plasmatice (după David). x7000
Orez. 75. Celula lui Mikulich în sclerom. În citoplasmă (C) sunt vizibile vacuole uriașe, care conțin bacili Volkovich-Frisch (B). PzK - celule plasmatice (după David). x7000
Granuloame nespecifice Nu Aveți trasaturi caracteristice inerente granuloamelor specifice. Acestea apar într-un număr de boli infecțioase (de exemplu, granuloame tifoide și tifoide) și neinfecțioase (de exemplu, granuloame de silicoză și azbestozitate, granuloame de corp străin).
Exod dublu granulom - necroză sau scleroză, a cărei dezvoltare este stimulată de monokinele (interleukina I) ale fagocitelor.
Inflamație productivă cu formarea de polipi și veruci genitale. O astfel de inflamație se observă pe membranele mucoase, precum și în zonele care mărginesc epiteliul scuamos. Se caracterizează prin creșterea epiteliului glandular împreună cu celulele țesutului conjunctiv subiacent, ceea ce duce la formarea multor papile mici sau formațiuni mai mari numite polipi. Astfel de creșteri de polipoză sunt observate cu inflamația prelungită a membranei mucoase a nasului, stomacului, rectului, uterului, vaginului etc. În zonele epiteliului scuamos, care este situat în apropierea prismaticului (de exemplu, în anus, organe genitale), membranele mucoase sunt separate, iritând constant epiteliul scuamos, duce la creșterea atât a epiteliului, cât și a stromei. Ca rezultat, apar formațiuni papilare - veruci genitale. Ele sunt observate în sifilis, gonoree și alte boli însoțite de inflamație cronică.
curgere inflamația productivă poate fi acută, dar în majoritatea cazurilor cronică. Curs acut inflamația productivă este caracteristică unui număr de boli infecțioase (tifoid și tifos, tularemie, reumatism acut, glomerulită acută), curs cronic- pentru majoritatea proceselor productive intermediare la nivelul miocardului, rinichilor, ficatului, mușchilor, care se termină în scleroză.
Exod inflamația productivă este diferită în funcție de tipul său, de natura cursului și de caracteristicile structurale și funcționale ale organului și țesutului în care apare. Inflamația cronică productivă duce la dezvoltarea focală sau difuză scleroză organ. Dacă în același timp se dezvoltă deformarea (ridarea) organului și restructurarea lui structurală, atunci se vorbește despre ciroză. Acestea sunt nefrociroza ca rezultat al glomerulonefritei cronice productive, ciroza hepatică ca rezultat al hepatitei cronice, pneumociroza ca rezultat al pneumoniei cronice etc.
Sens inflamația productivă este foarte mare. Se observă în multe boli și, cu un curs lung, poate duce la scleroză și ciroză a organelor și, prin urmare, la insuficiența lor funcțională.


